 图式 1
研究背景以及具有重要生物活性的含α-甲基仲康酸或2-氧化吲哚骨架的代表性分子
Scheme1.
Related background and selected biologically important molecules possessing α-methy-paraconic acid or 2-oxindole motif
图式 1
研究背景以及具有重要生物活性的含α-甲基仲康酸或2-氧化吲哚骨架的代表性分子
Scheme1.
Related background and selected biologically important molecules possessing α-methy-paraconic acid or 2-oxindole motif

Citation: Guo Yanjun, Meng Chenhong, Liu Xueli, Xu Danqian, Xia Aibao. An Efficient Asymmetric Construction of Novel Spiro-Fused 2-Oxindoles/α-Methy-paraconic Ester[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2776-2782. doi: 10.6023/cjoc201703013

不对称高效构筑新颖螺环氧化吲哚α-甲基仲康酸酯
-
关键词:
- 不对称合成
- / 螺环氧化吲哚γ-内酯
- / 仲康酸
English
An Efficient Asymmetric Construction of Novel Spiro-Fused 2-Oxindoles/α-Methy-paraconic Ester
-
Key words:
- asymmetric synthesis
- / spirooxindole γ-lactones
- / paraconic acids
-
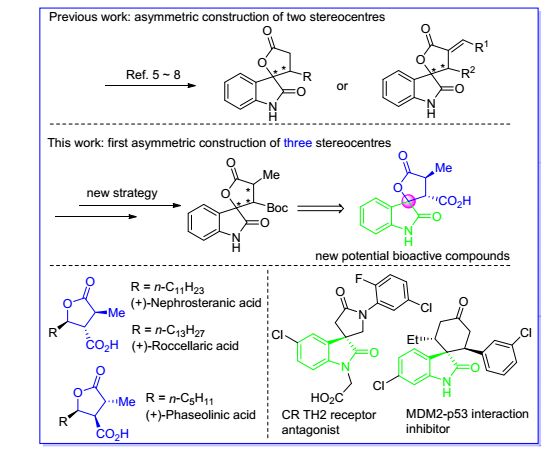
螺环氧化吲哚核心骨架广泛地存在于天然产物和临床药物之中[1].构筑复杂多样的手性螺环氧化吲哚化合物长期以来是有机合成及医药界的研究热点之一[2], 这是由于氧化吲哚与其它结构相组合所形成的新螺环分子有可能成为候选药物[3].此外, γ-内酯也是众多具有生物活性分子的核心骨架[4].基于上述原因, 螺环氧化吲哚γ-内酯化合物的构建引起了化学家们的浓厚兴趣.然而, 目前的合成策略, 如具有代表性的亚胺[5]、氮-杂卡宾[6]、金鸡纳碱衍生物[7]以及金属-手性配体复合物[8]等催化方式, 只能直接不对称构筑最多带有两个手性中心的螺环氧化吲哚γ-内酯(Scheme 1); 对于如何不对称构筑更加复杂的含有三个手性中心的螺环氧化吲哚γ-内酯, 例如螺环氧化吲哚/α-甲基仲康酸酯, 则仍然是一个挑战.仲康酸[9]是一类多取代的β-羧酸-γ-内酯天然产物, 而α-甲基仲康酸属于最为突出的仲康酸中的一类, 如Nephrosteranic acid, Roccellaric acid, Phaseolinic acid等具有抗肿瘤、抗菌、抑制艾滋病毒等生物活性[9] (Scheme 1).根据结构-活性相关性的药物设计原则[10], 将2-氧化吲哚与α-甲基仲康酸相结合所形成的新螺环氧化吲哚分子有可能具有重要的生物活性(Scheme 1).基于上述原因, 发展一种简易高效的方法用于手性螺环氧化吲哚α-甲基仲康酸的构筑显得尤为必要.
 图式 1
研究背景以及具有重要生物活性的含α-甲基仲康酸或2-氧化吲哚骨架的代表性分子
Scheme1.
Related background and selected biologically important molecules possessing α-methy-paraconic acid or 2-oxindole motif
图式 1
研究背景以及具有重要生物活性的含α-甲基仲康酸或2-氧化吲哚骨架的代表性分子
Scheme1.
Related background and selected biologically important molecules possessing α-methy-paraconic acid or 2-oxindole motif
经典的有机催化不对称Michael加成反应已成为合成光学活性羰基化合物的强有力工具[11].因此, 利用丰富易得的光学活性羰基化合物来构筑复杂多样的手性分子越来越受到有机合成科学家们的亲睐[12], 比如, 陈应春课题组[12a]于2010年报道了氧化吲哚烯烃与丙醛在Hayashi-J rgensen吡咯烷催化下首先进行Michael加成反应, 之后, 其Michael加成物可分别与α, β-不饱和醛、硝基烯烃、亚胺进行串联反应, 高对映选择性地构建了多取代的螺环氧化吲哚环己烷和哌啶骨架. 2016年, 钟国富课题组[12b]采用“一锅法”策略将氧化吲哚烯烃与脂肪醛的Michael加成物作为亲核试剂与脂肪醛进行Aldol/半缩醛化串联反应, 其中间体螺环氧化吲哚δ-内半缩醛在三氟化硼乙醚作用下被三乙基硅烷还原成螺环氧化吲哚四氢吡喃.在上述两课题组以及Melchiorre等[5]的工作基础之上, 笔者设计了如Scheme 2所示的不对称Michael加成/α-羟基化/半缩醛化/氧化的反应路径用于不对称构筑螺环氧化吲哚α-甲基仲康酸酯.首先, 氧化吲哚烯烃1a与丙醛在手性仲胺的催化下可高效地转化为2-氧化吲哚醛A; 之后, 在合适的氧化条件下, 中间体A经过α-羟基化反应生成相应的中间体B; 而中间体B在碱性条件下可顺利地经分子内半缩醛化反应生成螺环氧化吲哚内半缩醛C, 最后在PCC的氧化下可高效地转化为目标产物2a, 即螺环氧化吲哚α-甲基仲康酸酯.鉴于低浓度的双氧水具有廉价易得, 安全环保的特点, 本文将详细报道利用双氧水作为氧化剂首次实现2-氧化吲哚醛(即丙醛与氧化吲哚烯的Mihcael加成物)的氧化羟基化/半缩醛化串联反应.
1 结果与讨论
1.1 反应条件的优化
首先, 我们对合成螺环氧化吲哚内半缩醛C的反应条件进行了优化(表 1).以氧化吲哚烯烃1a与丙醛为底物, 第一步Michael加成反应在与已有报道[12a]相似的条件下进行, 待底物1a转化完毕, 脱溶, 然后加入4 equiv. H2O2, 1 equiv.碳酸钾, V(EtOAc):V(H2O)=10:1为溶剂, 反应于室温条件下搅拌4 h, 便可以90%的收率顺利地得到螺环氧化吲哚内半缩醛C (Entry 1).改用3 equiv. H2O2可取得80%的收率(Entry 2).对照实验(Entries 3~5) 表明:碱的加入对反应有较大影响.接下来考察了碱类对反应的影响, 发现无论是添加有机碱三乙胺还是无机碱碳酸钠均可取得较高的收率(Entries 6~7).此外, 我们还考察了溶剂对反应的影响.降低乙酸乙酯与水体积比至5:1, 收率有轻微降低(Entry 8), 使用疏水性的甲苯/水两相溶剂体系可取得87%的收率(Entry 10), 而亲水性的乙腈替代乙酸乙酯使得反应收率降至74% (Entry 9).另外, 我们也对实验室常用氧化剂, 如TBHP, Oxone, mCPBA, IBX等, 进行了筛查, 遗憾的是没有取得更理想的效果.

Entry Variation from “standard condition” Yieldb/% 1 None 90 2 3 equiv. H2O2 80 3 Without K2CO3 63 4 Without H2O 83 5 Without K2CO3 and H2O 59 6 1 equiv. NEt3 instead of K2CO3 86 7 1 equiv. NaCO3 instead of K2CO3 83 8 V(EtOAc)/V(H2O)=5:1 85 9 V(CH3CN)/V(H2O)=10:1 74 10 V(Toluene)/V(H2O)=10:1 87 aStandard condition: using 1a (0.2 mmol), propaldehyde (20 µL, 1.2 equiv.), Cat. (2.5 mol%), and PhCOOH (5 mol%) in 0.5 mL of CH3CN for 1 h; the solvent was then removed and [EtOAc (1 mL)+H2O (0.1 mL)], H2O2 (4 equiv.), K2CO3 (1 equiv.) were added, the reaction run at r.t. for 4 h. bIsolated yield. 1.2 底物拓展
以最优的反应条件, 我们考察了各种氧化吲哚烯烃底物对反应的普适性(表 2).从表 2可以看出, 一系列苯环上具有多种取代模式(5、6、7位)和不同电子效应(给电子和吸电子)的氧化吲哚烯烃1都可顺利地与丙醛进行不对称Michael加成/氧化半缩醛化/氧化γ-内酯化反应, 以优秀的收率、中等的非对映选择性和优秀的对映选择性获得目标产物螺环氧化吲哚α-甲基仲康酸酯化合物(2a~2n, 表 2).此外, 以1a为研究对象, 通过1HNMR对其与丙醛的Michael加成物中间体A以及A的氧化内酯化产物2a的dr值进行对比分析, 发现经两次氧化反应后, 非对映选择性有较大幅度提高(from 7:3:2:1 to 12:1:1).另外, 我们还对底物的普适性进行更深入地考察, 发现位阻较小的乙酯基团对产物的收率影响甚微, 但是其对产物主要非对映体的对映选择性有较大影响, 所得ee值较低, 为83% (Eq. 1).

Entry R Product Yieldb/% drc eed/% 1 H 2a 95 12:1:1:0 93 2 5-Me 2b 96 10:1:1:0 91 3 5-MeO 2c 94 11:1:1:0 91 4 5-F 2d 95 11:1:1:0 95 5 5-Cl 2e 97 7:1:1:0 90 6 5-Br 2f 91 6:1:1:0 91 7 5-I 2g 97 12:1:1:1 87 8 5-CF3O 2h 97 9:1:1:0 95 9 6-Cl 2i 95 8:1:1:0 93 10 6-Br 2j 98 11:2:1:0 91 11 7-F 2k 92 6:1:1:0 95 12 7-Cl 2l 95 13:2:1:0 95 13 7-Br 2m 93 11:2:1:0 92 14 7-CF3 2n 96 11:2:1:0 91 aReaction conditions: (1) 1 (0.4 mmol), propaldehyde (40 µL, 1.2 equiv.), Cat. (2.5 mol%), and PhCOOH (5 mol%); (2) H2O2 (1.6 mmol), K2CO3 (0.4 mmol); (3) PCC (1.2 mmol). bIsolated yields. cDetermined by 1H NMR analysis. dDetermined by chiral HPLC. 最后, 产物的主要非对映体的绝对构型(2'R, 3'R, 3S)通过对2m进行单晶衍射得到了确定, CCDC号为1535625 [13](图 1).
2 结论
成功开发了一种新型的不对称催化与氧化γ-内酯化相结合的合成策略用于构筑新颖的具有潜在生物活性的螺环氧化吲哚α-甲基仲康酸衍生物.在手性仲胺与H2O2、PCC的接力作用下, 各种取代的氧化吲哚烯烃与丙醛顺利地经过Michael加成/α-羟基化/半缩醛化/氧化反应, 高产率地得到一系列含三个手性中心的对映选择性优异的螺环氧化吲哚γ-内酯化合物.该反应具有反应条件温和、反应选择性高、操作简单等优点.
3 实验部分
3.1 仪器与试剂
熔点由Büchi B-545熔点仪测定(温度未经校正); 1H NMR和13C NMR均在德国Bruker公司500 MHz核磁共振仪上测定, 溶剂CDCl3, 内标TMS; 高分辨质谱使用Agilent 1200液相色谱-6210飞行时间质谱仪测定; 对映选择性使用JASCO LC-2000设备和大赛璐手性色谱柱测定.实验所用药品和试剂均为市售的分析纯或化学纯, 除特别说明外, 未经进一步处理.
3.2 实验方法
向加有搅拌磁子的Schlenk反应管(10 mL)中一次加入氧化吲哚烯烃1 (0.4 mmol)、苯甲酸(5 mol%)、(2S)-2-[二苯基(三甲基硅烷氧基)甲基]吡咯烷(2.5 mol%)、丙醛(40 μL)、乙腈(0.8 mL).该反应体系在室温下反应1~5 h.待Michael加成反应结束后, 通过旋转蒸发仪除去有机溶剂, 之后再向反应管中加入K2CO3 (1 equiv.), H2O2 (4 equiv. 30 wt%), 乙酸乙酯(2 mL), 水(0.2 mL).反应体系于室温下搅拌4~8 h, 萃取, 干燥, 利用旋转蒸发仪除去有机溶剂, 于残留物中加入氯铬酸吡啶(PCC) (3.0 equiv.), 无水二氯甲烷4 mL, 室温下反应16 h.反应液经短柱并用乙酸乙酯淋洗, 所得有机相经旋转蒸发仪脱溶, 残留物通过柱层析(石油醚和乙酸酯混合液为洗脱剂)方法分离出目标产物2, 干燥、称量质量确定收率.所有产物均经过核磁共振光谱和高分辨质谱确认.
叔丁基(2S, 3R, 4R)-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2a):白色固体, 产率95%. 12:1:1 dr. For the major isomer: 93% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=54.6 min, tminor=21.8 min]. m.p. 155~156 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.18 (s, 1H), 7.36 (td, J=8.0, 1.5 Hz, 1H), 7.22 (d, J=7.5 Hz, 1H), 7.07 (td, J=7.5, 1.0 Hz, 1H), 6.95 (d, J=8.0 Hz, 1H), 3.54 (d, J=12.0 Hz, 1H), 3.46~3.40 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.04 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 176.1, 174.2, 166.4, 141.5, 131.5, 125.0, 124.9, 123.5, 110.7, 82.8, 80.6, 55.0, 36.3, 27.2 (3C), 15.0; HRMS calcd for C17H23N2O5 [M+NH4]+335.1601, found 335.1607.
叔丁基(2S, 3R, 4R)-4, 5'-二甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2b):白色固体, 产率96%. 10:1:1 dr. For the major isomer: 91% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=55.2 min, tminor=21.4 min]. m.p. 184~185 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.30 (s, 1H), 7.14 (d, J=7.5 Hz, 1H), 7.02 (s, 1H), 6.84 (d, J=8.0 Hz, 1H), 3.53 (d, J=12.0 Hz, 1H), 3.47~3.40 (m, 1H), 2.29 (s, 3H), 1.48 (d, J=6.5 Hz, 3H), 1.04 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 176.2, 174.0, 166.5, 138.9, 133.2, 131.6, 125.6, 124.9, 110.3, 82.8, 80.7, 54.9, 36.3, 27.2 (3C), 20.9, 15.0; HRMS calcd for C18H25N2O5 [M+NH4]+ 349.1758, found 349.1754.
叔丁基(2S, 3R, 4R)-5'-甲氧基-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2c):白色固体, 产率94%. 11:1:1 dr. For the major isomer: 91% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=61.0 min, tminor=27.5 min]. m.p. 175~177 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.37 (d, J=12.0 Hz, 1H), 6.88 (s, 2H), 6.79 (s, 1H), 3.76 (s, 3H), 3.54 (d, J=12.0 Hz, 1H), 3.46~3.38 (m, 1H), 1.48 (d, J=7.0 Hz, 3H), 1.06 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 176.1, 174.2, 166.4, 156.4, 134.7, 125.9, 116.4, 111.8, 111.2, 82.8, 81.0, 56.1, 54.9, 36.3, 27.3 (3C), 15.0; HRMS calcd for C18H25N2O6 [M+NH4]+ 365.1707, found 365.1717.
叔丁基(2S, 3R, 4R)-5'-氟-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2d):白色固体, 产率95%.11:1:1 dr. For the major isomer: 95% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=29.7 min, tminor=14.6 min]. m.p. 196~197 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.73 (s, 1H), 7.12~7.06 (m, 1H), 6.98 (dd, J=7.5, 2.5 Hz, 1H), 6.93 (dd, J=8.5, 4.0 Hz, 1H), 3.53 (d, J=12.0 Hz, 1H), 3.42~3.36 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.08 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.8, 174.3, 166.1, 159.1 (d, J=242.6 Hz, 1C), 137.5, 126.2 (d, J=7.6 Hz, 1C), 118.0 (d, J=23.4 Hz, 1C), 113.1 (d, J=25 Hz, 1C), 111.5 (d, J=7.6 Hz, 1C), 83.1, 80.6, 54.9, 36.2, 27.3 (3C), 14.9; HRMS calcd for C17H22N2O5 [M+NH4]+ 353.1507, found 353.1503.
叔丁基(2S, 3R, 4R)-5'-氯-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2e):白色固体, 产率97%. 7:1:1 dr. For the major isomer: 90% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=26.7 min, tminor=12.6 min]. m.p. 197~198 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.26 (s, 1H), 7.35 (dd, J=8.5, 2.0 Hz, 1H), 7.21 (d, J=2.0 Hz, 1H), 6.90 (d, J=8.0 Hz, 1H), 3.53 (d, J=12.0 Hz, 1H), 3.44~3.37 (m, 1H), 1.49 (d, J=7.0 Hz, 3H), 1.09 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.7, 173.8, 166.1, 140.1, 131.4, 128.9, 126.5, 125.4, 111.7, 83.1, 80.3, 54.9, 36.3, 27.3 (3C), 15.0; HRMS calcd for C17H22ClN2O5 [M+NH4]+ 369.1212, found 369.1209.
叔丁基(2S, 3R, 4R)-5'-溴-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-3-二氢吲哚]-3-羧酸(2f):白色固体, 产率91%. 6:1:1 dr. For the major isomer: 91% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=24.5 min, tminor=12.3 min]. m.p. 196~198 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.17 (s, 1H), 7.50 (dd, J=8.0, 2.0 Hz, 1H), 7.34 (d, J=2.0 Hz, 1H), 6.85 (d, J=8.0 Hz, 1H), 3.53 (d, J=12.0 Hz, 1H), 3.43~3.36 (m, 1H), 1.49 (d, J=7.0 Hz, 3H), 1.10 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.7, 173.7, 166.1, 140.5, 134.3, 128.1, 126.9, 115.9, 112.2, 83.2, 80.2, 54.9, 36.3, 27.3 (3C), 15.0; HRMS calcd for C17H22BrN2O5 [M+NH4]+ 413.0707, found 413.0705.
叔丁基(2S, 3R, 4R)-5'-碘-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2g):白色固体, 产率97%.12:1:1:1 dr. For the major isomer: 87% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=23.8 min, tminor=12.6 min]. m.p. 191~193 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.37 (s, 1H), 7.69 (dd, J=8.0, 1.5 Hz, 1H), 7.49 (s, 1H), 6.76 (d, J=8.0 Hz, 1H), 3.52 (d, J=12.0 Hz, 1H), 3.42~3.36 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.09 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.7, 173.4, 166.1, 141.1, 140.2, 133.6, 127.3, 112.7, 85.3, 83.2, 80.0, 54.9, 36.3, 27.3 (3C), 15.0; HRMS calcd for C17H22IN2O5 [M+NH4]+ 461.0568, found 461.0569.
叔丁基(2S, 3R, 4R)-5'-三氟甲氧基-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2h):白色固体, 产率97%. 9:1:1 dr. For the major isomer: 95% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=13.5 min, tminor=8.0 min]. m.p. 152~154 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.43 (s, 1H), 7.25 (s, 1H), 7.11 (s, 1H), 6.99 (d, J=8.5 Hz, 1H), 3.55 (d, J=12.0 Hz, 1H), 3.44~3.37 (m, 1H), 1.49 (d, J=6.5 Hz, 3H), 1.07 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.8, 174.4, 166.0, 144.9, 140.4, 126.2, 124.8, 119.1, 111.5, 83.2, 80.4, 54.9, 36.2, 27.6, 27.2 (3C), 14.9; HRMS calcd for C18H22F3N2O6 [M+NH4]+ 419.1424, found 419.1434.
叔丁基(2S, 3R, 4R)-6'-氯-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2i):白色固体, 产率95%. 8:1:1 dr. For the major isomer: 95% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=37.6 min, tminor=15.6 min]. m.p. 196~198 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.45 (s, 1H), 7.14 (d, J=8.0 Hz, 1H), 7.06 (dd, J=8.0, 1.5 Hz, 1H), 7.00 (d, J=1.5 Hz, 1H), 3.52 (d, J=12.0 Hz, 1H), 3.43~3.36 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.09 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.9, 174.0, 166.2, 142.7, 137.4, 125.9, 123.4, 123.2, 111.4, 83.1, 80.0, 54.9, 36.2, 27.3 (3C), 14.9; HRMS calcd for C17H22ClN2O5 [M+NH4]+ 369.1212, found 369.1210.
叔丁基(2S, 3R, 4R)-6'-溴-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2j):白色固体, 产率98%. 11:2:1 dr. For the major isomer: 91% ee [Dciel Chiralpak IC-H column (0.46 mm×250 mmL ID)], V(n-hexane):V(i-PrOH)=90:10, 1.0 mL/min, 254 nm; tmajor=46.2 min, tminor=16.5 min]. m.p. 195~197 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.14 (s, 1H), 7.23 (dd, J=8.0, 1.5 Hz, 1H), 7.15 (d, J=1.5 Hz, 1H), 7.08 (d, J=8.0 Hz, 1H), 3.52 (d, J=12.0 Hz, 1H), 3.42~3.36 (m, 1H), 1.48 (d, J=7.0 Hz, 3H), 1.09 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.9, 174.0, 166.2, 142.8, 126.3, 126.1, 125.2, 123.7, 114.2, 83.1, 80.1, 54.9, 36.2, 27.3 (3C), 14.9; HRMS calcd for C17H22BrN2O5 [M+NH4]+ 413.0707, found 413.0707.
叔丁基(2S, 3R, 4R)-7'-氟-4-甲基-2’, 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2k):白色固体, 产率92%. 6:1:1 dr. For the major isomer: 95% ee [Dciel Chiralpak AD-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=95:5, 0.7 mL/min, 254 nm; tmajor=33.5 min, tminor=38.5 min]. m.p. 196~198 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.98 (s, 1H), 7.19~7.15 (m, 1H), 7.07~7.03 (m, 2H), 3.55 (d, J=12.5 Hz, 1H), 3.43~3.36 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.07 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.8, 173.2, 166.2, 147.2 (d, J=244.5 Hz, 1C), 129.0 (d, J=12.9 Hz, 1C), 127.5 (d, J=3.0 Hz, 1C), 124.2 (d, J=5.8 Hz, 1C), 120.5 (d, J=3.5 Hz, 1C), 118.5 (d, J=16.9 Hz, 1C), 83.0, 80.4 (d, J=3.3 Hz, 1C), 55.1, 36.1, 27.3 (3C), 14.9; HRMS calcd for C17H22FN2O5 [M+NH4]+ 353.1507, found 353.1502.
叔丁基(2S, 3R, 4R)-7'-氯-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2l):白色固体, 产率95%. 13:2:1 dr. For the major isomer: 95% ee [Dciel Chiralpak AD-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=95:5, 0.7 mL/min, 254 nm; tmajor=44.6 min, tminor=49.0 min]. m.p. 196~198 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.86 (s, 1H), 7.37 (dd, J=8.0, 1.0 Hz, 1H), 7.13 (d, J=7.5 Hz, 1H), 7.04 (t, J=8.0 Hz, 1H), 3.54 (d, J=12.0 Hz, 1H), 3.41~3.35 (m, 1H), 1.48 (d, J=6.5 Hz, 3H), 1.06 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.7, 172.9, 166.2, 139.3, 131.1, 126.4, 124.2, 123.0, 116.0, 83.0, 81.0, 55.2, 36.1, 27.3 (3C), 14.9; HRMS calcd for C17H22ClN2O5 [M+NH4]+ 369.1212, found 369.1204.
叔丁基(2S, 3R, 4R)-7'-溴-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2m):白色固体, 产率93%. 11:2:1 dr. For the major isomer: 92% ee [Dciel Chiralpak AD-H column (0.46 mm×250 mmL ID), n-hexane/i-PrOH=95:5, 0.7 mL/min, 254 nm; tmajor=50.8 min, tminor=54.4 min]. m.p. 194~196 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.76 (s, 1H), 7.50 (dd, J=8.5, 1.0 Hz, 1H), 7.16 (d, J=7.5 Hz, 1H), 6.98 (t, J=8.0Hz, 1H), 3.53 (d, J=12.0 Hz, 1H), 3.41~3.34 (m, 1H), 1.48 (d, J=7.0 Hz, 3H), 1.06 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.7, 172.7, 166.1, 140.9, 133.9, 126.3, 124.6, 123.6, 103.7, 83.1, 81.3, 55.3, 36.1, 27.3 (3C), 14.9; HRMS calcd for C17H22BrN2O5 [M+NH4]+ 413.0707, found 413.0701.
叔丁基(2S, 3R, 4R)-7'-三氟甲基-4-甲基-2', 5-二氧代-4, 5-二氢-3H-螺[呋喃-2, 3'-二氢吲哚]-3-羧酸(2n):白色固体, 产率96%. 11:2:1 dr. For the major isomer: 91% ee [Dciel Chiralpak AD-H column (0.46 mm×250 mmL ID), V(n-hexane):V(i-PrOH)=95:5, 0.7 mL/min, 254 nm; tmajor=36.0 min, tminor=43.5 min]. m.p. 203~205 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.95 (s, 1H), 7.59 (d, J=8.0 Hz, 1H), 7.40 (d, J=7.5 Hz, 1H), 7.20 (t, J=7.5 Hz, 1H), 3.56 (d, J=12.5 Hz, 1H), 3.45~3.39 (m, 1H), 1.49 (d, J=7.0 Hz, 3H), 1.04 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 175.6, 173.1, 166.1, 139.1 (d, J=2 Hz, 1C), 128.3, 127.9 (q, J=4 Hz, 1C), 126.7, 123.4 (d, J=270.4 Hz, 1C), 123.3, 113.1 (q, J=33.4 Hz, 1C), 83.2, 79.0, 55.0, 36.1, 27.1 (3C), 15.0; HRMS calcd for C18H22F3N2O5 [M+NH4]+ 403.1475, found 403.1486.
辅助材料(Supporting Information) 产物2a~2n的核磁共振谱图、Chiral-HPLC分析图.这些材料可以免费从本刊网站(http://siocjournal.cn/)上下载.
-
-
[1]
(a) Santos, M. M. M Tetrahedron 2014, 70, 9735.
(b) Lin, H.; Danishefsky, S. J. Angew. Chem., Int. Ed. 2003, 42, 36. -
[2]
肖永龙, 周宇, 王江, 王进欣, 柳红, 有机化学, 2015, 35, 2035. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345117.shtml(a) Xiao, Y. L.; Zhou, Y.; Wang, J.; Wang, J. X.; Liu. H. Chin. J. Org. Chem. 2015, 35, 2035 (in Chinese).
(b) Cheng, D.; Ishihara, Y.; Tan, B.; Barbas, C. F. ACS Catal. 2014, 4, 743.
(c) Franz, A. K.; Hanhan, N. V.; Ball-Jones, N. R. ACS Catal. 2013, 3, 540.
(d) Trost, B. M.; Brennan, M. K. Synthesis 2009, 3003. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345117.shtml -
[3]
(a) Singh, G. S.; Desta, Z. Y. Chem. Rev.2012, 112, 6104.
(b) Galliford, C. V.; Scheidt, K. A. Angew. Chem., Int. Ed.2007, 46, 8748.
(c) Marti, C.; Carreira, E. M. Eur. J. Org. Chem. 2003, 2209.
(d) Heindel, N. D.; Minatelli, J. A. J. Pharm. Sci. 1981, 70, 84. -
[4]
(a) Kitson, R. R. A.; Millemaggi, A.; Taylor, R. J. K. Angew. Chem., Int. Ed. 2009, 48, 9426.
(b) Roach, J. S.; LeBlanc, P.; Lewis, N. I.; Munday, R.; Quilliam, M. A.; MacKinnon, S. L. J. Nat. Prod. 2009, 72, 1237.
(c) Saleem, M.; Kim, H. J.; Ali, M. S.; Lee, Y. S. Nat. Prod. Rep.2005, 22, 696. -
[5]
Bergonzini, G.; Melchiorre, P. Angew. Chem., Int. Ed. 2012, 51, 971. doi: 10.1002/anie.v51.4
-
[6]
(a) Xu, J. F.; Yuan, S. R.; Miao, M. Z.; Chen, Z. K. J. Org. Chem. 2016, 81, 11454.
(b) Xie, Y. W.; Yu, C. X.; Li, T. J.; Tu, S. J.; Yao, C. S. Chem.-Eur.J. 2015, 21, 5355.
(c) Jin, Z. C.; Jiang, K.; Fu, Z, Q.; Torres, J.; Zheng, P. C.; Yang, S.; Song, B. A.; Chi, Y. G. R. Chem.-Eur. J. 2015, 21, 9360.
(d) Zheng, C. G.; Yao, W. J.; Zhang, Y. C.; Ma, C. Org. Lett. 2014, 16, 5028.
(e) Dugal-Tessier, J.; O'Bryan, E. A.; Schroeder, T. B. H.; Cohen, D. T.; Scheidt, K. A. Angew. Chem., Int. Ed. 2012, 51, 4963.
(f) Sun, L. H.; Shen, L. T.; Ye, S. Chem. Commun. 2011, 47, 10136. -
[7]
(a) Chen, L.; Wu, Z. J.; Zhang, M. L.; Yue, D. F.; Zhang, X. M.; Xu, X. Y.; Yuan, W. C. J. Org. Chem. 2015, 80, 12668.
(b) Jayakumar, S.; Muthusamy, S.; Prakash, M.; Kesavan, V. Eur. J.Org. Chem. 2014, 1893.
(c) Wang, Q. L.; Peng, L.; Wang, F. Y.; Zhang, M. L.; Jia, L. N.; Tian, F.; Xu, X. Y.; Wang, L. X. Chem. Commun. 2013, 49, 9422. -
[8]
(a) Murata, Y.; Takahashi, M.; Yagishita, F.; Sakamoto, M.; Sengoku, T.; Yoda, H. Org. Lett. 2013, 15, 6182.
(b) Trost, B. M.; Hirano, K. Org. Lett. 2012, 14, 2446. -
[9]
Bandichhor, R.; Reiser, O. Top. Curr. Chem. 2005, 243, 43.
-
[10]
(a) Rana, S.; Blowers, E. C.; Tebbe, C.; Contreras, J. I.; Radhakrishnan, P.; Kizhake, S.; Zhou, T.; Rajule, R. N.; Arnst, J. L.; Munkarah, A. R.; Rattan, R.; Natarajan, A. J. Med. Chem. 2016, 59, 5121.
(b) Creager, K.; Jordan, T. H. Drugs Future 2002, 27, 577.
(c) Dudek, A. Z.; Arodz, T.; Galvez, J. Comb. Chem. High Throughput Screening 2006, 9, 213. -
[11]
李宁, 郗国宏, 吴秋华, 刘伟华, 马晶军, 王春, 有机化学, 2009, 29, 1018. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract328715.shtml(a) Li, N.; Xi, G. H; Wu, Q. H.; Liu, W. H.; Ma, J. J.; Wang, C. Chin.J. Org. Chem. 2009, 29, 1018 (in Chinese).
(b) Jensen, K. L.; Dickmeiss, G.; Jiang, H.; Albrecht, Ł.; JØ rgensen, K. A. Acc. Chem.Res. 2011, 45, 248. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract328715.shtml -
[12]
于璐, 程玉宇, 李柔, 焦艳华, 李鹏飞, 有机化学, 2016, 36, 1572. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345583.shtml(a) Jiang, K.; Jia, Z. J.; Chen, S.; Wu, L.; Chen, Y. C. Chem.-Eur. J. 2010, 16, 2852.
(b) Zhu, L. Y.; Chen, Q. L.; Shen, D.; Zhang, W. H.; Shen, C.; Zeng, X. F.; Zhong, G. F. Org. Lett. 2016, 18, 2387.
(c) Yu, L.; Cheng, Y. Y.; Li, R.; Jiao, Y. H.; Li, P. F. Chin. J.Org. Chem. 2016, 36, 1572 (in Chinese).
(d) Enders, D.; Hüttl, M. R. M.; Grondal, C.; Raabe, G. Nature 2006, 441, 861.
(e) Han, B.; Xiao, Y. C.; He, Z. Q.; Chen, Y. C. Org. Lett. 2009, 11, 4660.
(f) Hahn, R.; Raabe, G.; Enders, D. Org. Lett. 2014, 16, 3636.
(g) Zhou, R.; Wu, Q.; Guo, M.; Huang, W.; He, X.; Yang, L.; Peng, F.; He, G.; Han, B. Chem. Commun. 2015, 51, 13113.
(h) Xie, X.; Peng, C.; He, G.; Leng, H.-J.; Wang, B.; Huang, W.; Han, B. Chem.Commun. 2012, 48, 10487. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345583.shtml
-
[1]
-
表 1 不对称“一锅法”合成螺环氧化吲哚γ-内半缩醛a
Table 1. Asymmetric one-pot synthesis of spirooxindole γ-lactol

Entry Variation from “standard condition” Yieldb/% 1 None 90 2 3 equiv. H2O2 80 3 Without K2CO3 63 4 Without H2O 83 5 Without K2CO3 and H2O 59 6 1 equiv. NEt3 instead of K2CO3 86 7 1 equiv. NaCO3 instead of K2CO3 83 8 V(EtOAc)/V(H2O)=5:1 85 9 V(CH3CN)/V(H2O)=10:1 74 10 V(Toluene)/V(H2O)=10:1 87 aStandard condition: using 1a (0.2 mmol), propaldehyde (20 µL, 1.2 equiv.), Cat. (2.5 mol%), and PhCOOH (5 mol%) in 0.5 mL of CH3CN for 1 h; the solvent was then removed and [EtOAc (1 mL)+H2O (0.1 mL)], H2O2 (4 equiv.), K2CO3 (1 equiv.) were added, the reaction run at r.t. for 4 h. bIsolated yield. 表 2 3-烯基氧化吲哚底物1的普适性a
Table 2. Scope of 3-ylideneoxindoles

Entry R Product Yieldb/% drc eed/% 1 H 2a 95 12:1:1:0 93 2 5-Me 2b 96 10:1:1:0 91 3 5-MeO 2c 94 11:1:1:0 91 4 5-F 2d 95 11:1:1:0 95 5 5-Cl 2e 97 7:1:1:0 90 6 5-Br 2f 91 6:1:1:0 91 7 5-I 2g 97 12:1:1:1 87 8 5-CF3O 2h 97 9:1:1:0 95 9 6-Cl 2i 95 8:1:1:0 93 10 6-Br 2j 98 11:2:1:0 91 11 7-F 2k 92 6:1:1:0 95 12 7-Cl 2l 95 13:2:1:0 95 13 7-Br 2m 93 11:2:1:0 92 14 7-CF3 2n 96 11:2:1:0 91 aReaction conditions: (1) 1 (0.4 mmol), propaldehyde (40 µL, 1.2 equiv.), Cat. (2.5 mol%), and PhCOOH (5 mol%); (2) H2O2 (1.6 mmol), K2CO3 (0.4 mmol); (3) PCC (1.2 mmol). bIsolated yields. cDetermined by 1H NMR analysis. dDetermined by chiral HPLC. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 2486
- HTML全文浏览量: 159




 下载:
下载:


 下载:
下载:

