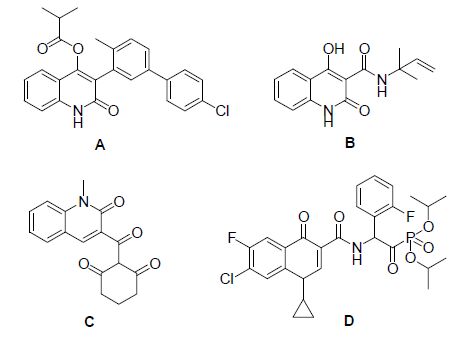
 图 1
活性化合物的结构
Figure 1.
The structure of activity compounds
图 1
活性化合物的结构
Figure 1.
The structure of activity compounds

Citation: Cheng Hua, Wang Wanqiang, Huang Lin, Cui Ping, Wu Qiongyou. Synthesis and Biological Activities of Novel Triazolesulfonamide Derivatives Containing Quinolin-2-one Moiety[J]. Chinese Journal of Organic Chemistry, 2016, 36(5): 1065-1072. doi: 10.6023/cjoc201510013

新型含喹啉酮结构的三唑磺酰胺衍生物的合成及其对线粒体复合物III的抑制活性
-
关键词:
- 2-喹啉酮
- / 1,2,4-三唑磺酰胺
- / 琥珀酸-细胞色素c氧化还原酶
- / 抑制活性
- / 合成
English
Synthesis and Biological Activities of Novel Triazolesulfonamide Derivatives Containing Quinolin-2-one Moiety
-
线粒体呼吸链复合体Ⅲ (简称线粒体复合物Ⅲ),也叫细胞色素c还原酶(cytochrome creductase)或bc1复合物,它是线粒体电子传递链的中心元素[1],也是杀菌剂的重要作用靶标之一. 近年来,随着鸡心、牛心、兔心、酵母等不同来源的线粒体复合物Ⅲ的晶体结构陆续被成功解析[2~4],其内部的电子传递过程也清晰地呈现在人们眼前. 复合物Ⅲ有两个醌的功能结合位点即还原型辅酶Q的氧化位点(Qo位点)和氧化型辅酶Q的还原位点(Qi位点)[5~7]. 基于此,作用于复合物Ⅲ的杀菌剂可分为Qo位点抑制剂和Qi位点抑制剂[8, 9],其中Qo位点杀菌剂取得了巨大的成功,典型的Qo位点抑制剂包括甲氧丙烯酸酯类,唑菌酮、黏噻唑、标桩菌素 等[10]. 相对而言,Qi位点抑制剂品种较少,仅有氰霜唑、吲唑磺菌胺等为数不多的商品化抑制剂[11]. 发展Qi位点抑制剂是解决Qo位点杀菌剂如甲氧丙烯酸酯类杀菌剂所带来的越来越严重的抗性问题的有效途径.
喹啉酮是含有喹啉环结构的一类重要杂环化合物,天然的2(1H)-喹啉酮类物质主要存在于一些天然植物中如吴茱萸、常青树等的生物碱中[12],随着取代基的不同,喹啉酮类化合物呈现出不同的生物活性以及广阔的药理和生理活性,在化工、医药等领域都有很广泛的应用. 在农药领域中,喹啉酮环结构的化合物被广泛应用于各种除草剂、杀虫剂及杀菌剂. 拜尔公司新开发的化合物A具有除草和杀虫活性[13],化合物B是由巴斯夫公司研发的一种新型化合物,主要用来防治稗草、矢车菊等[14],化合物C是先正达公司新报道的一类除草剂[15],化合物D是贵州大学宋宝安课题组[16]报道的具有杀菌活性小分子.
我们课题组在前期以线粒体复合物Ⅲ为靶标筛选新型杀菌剂的过程中发现,吲唑磺菌胺的三唑磺酰胺部分是一类高效的杂环片段,通过结构修饰可以筛选到高活性的复合物Ⅲ抑制剂. 因此,本文中我们采用活性亚结构拼接和生物合理设计的方法,将喹啉酮活性结构单元引入到三唑磺酰胺结构中,设计了一系列未见文献报道的新型含喹啉酮结构的三唑磺酰胺类化合物,利用 1H NMR、13C NMR及元素分析对目标化合物的结构进行了表征. 测试了所合成的目标化合物对猪心线粒体复合物Ⅲ的抑制活性,结果表明该类化合物均对复合物Ⅲ具有一定抑制效果,其中,目标化合物6f [IC50=(45.75±1.02) μmol/L]对复合物Ⅲ的抑制活性优于对照药剂吲唑磺菌胺. 目标化合物的合成路线如Scheme 1 所示.
1 结果与讨论
1.1 二硫化合物的合成
合成关键中间体三唑磺酰氯3时,主要是构建二硫键,该反应机理已有文献报道[17](Scheme 2),从反应机理可知巯基先和磺酰氯生成酯,再被还原成二硫化合物,如果苯磺酰氯的用量过多会导致反应停留在第一步反应,若用量过少,则反应难以进行完全,根据总反应方程式可以得知: 苯磺酰氯和二硫化物的物质的量的比为1:2最佳,另外苯磺酰氯不稳定,所以反应中所用的反应原料、缚酸剂、反应溶剂都要干燥; 由于二硫化物不稳定,容易被氧化,所以反应过程中要氮气保护,在干燥时,温度也不宜过高,一般在真空干燥箱里进行干燥.
1.2 喹啉酮的合成
喹啉酮的合成过程是经过傅克烷基化反应后关环,其反应机理如Scheme 3所示[18]. 该反应中路易斯酸必须是无水的,路易斯酸和反应原料的物质量的比为3:1,另外,该反应用到的溶剂高沸点氯苯,因为高温能促进苯环的离去,有利于喹啉酮的生成. 实验中我们发现苯环上的取代基对喹啉酮的合成有一定的影响,当苯环上为单取代时其收率(5f,82%)要高于二取代(5l,64%),而对单取代芳基而言,供电子基团的收率(5e,80%)要高于吸电子基团(5b,54%).
1.3 目标化合物的合成
在制备目标化合物时,为优化反应条件,我们以化合物6a的合成为模板,考察了反应溶剂及碱对反应的影响: 以三乙胺为碱时,我们发现反应可在多种溶剂中进行如THF、DMF、DCM,DMSO,其中,在THF、DMF和DMSO中反应产率相当,但DMF和DMSO作溶剂时,反应时间比THF稍快,考虑到THF作溶剂时后处理先对简单,我们最终采用沸点较低的THF作溶剂 ; 然后,我们考察了不同碱如吡啶、DMAP、K2CO3、Cs2CO3、NaH对反应的影响,发现以K2CO3、Cs2CO3、NaH为碱时均可得到中等收率的目标产物,其中以NaH作碱时,反应时间最短,产率最高可达83%. 因此,所有目标产物的制备均以NaH为碱、THF为溶剂进行.
1.4 目标化合物的活性研究
化合物对线粒体复合物Ⅲ的抑制活性结果列于表 2,由表 2可知,多数目标化合物对复合物Ⅲ具有一定的抑制活性,其中6a,6e,6i,6f在100 μmol/L浓度下的酶抑制率分别为35%,30%,35%和59%,特别值得一提的是化合物6f的抑制率达到了59%,明显优于对照药剂吲唑磺菌胺的抑制率45%,同时,我们测试了该化合物的IC50,结果表明,该化合物抑制活性高于对照商品化药剂吲唑磺菌胺2倍以上,可作为先导结构进行进一步优化.
2 结论
在课题组前期研究的基础上,采用活性亚结构拼接和生物合理设计的方法,将具有广泛生物活性的喹啉酮结构单元与商品化杀菌剂吲唑磺菌胺的三唑磺酰胺结构进行杂化,设计合成了14个未见文献报道的新型含喹啉酮结构的三唑磺酰胺类化合物. 利用1H NMR、13C NMR及元素分析对目标化合物的结构进行了表征. 测试了所合成的目标化合物对猪心线粒体复合物Ⅲ的抑制活性,发现目标化合物6f [IC50=(45.75±1.02) μmol/L]对复合物Ⅲ的抑制活性较对照药剂吲唑磺菌胺提高了一倍,可作为先导结构进行一步优化.
3 实验部分
3.1 仪器与试剂
1H NMR谱图数据由Mercury Plus 400MHz核磁共振仪或者Varian VNMR 600MHz (TMS为内标,氘代氯仿、氘代DMSO为溶剂),质谱数据由Finnigan Trace MS 质谱仪测定,熔点由BüCHI B-545数字熔点仪(温度未经校正)测定; 此外,合成过程中用到的仪器有: 德国Heidolph MR3001型恒温加热磁力搅拌器,瑞士BüCHI R-200型旋转蒸发仪、德国Sartoruis电子天平、ZF-200 暗箱式紫外分析仪、DLSB低温冷却循环泵、S HZ-D(Ⅲ) 循环水式真空泵、70-1型远红外线干燥箱、Zk-82BB型电热真空干燥箱和KQ-100DZ型数控超声波清洗仪等仪器. 柱层析所用硅胶(200~300目)和点样硅胶板由青岛海洋化工厂提供,所使用石油醚沸程为60~90 ℃; 其它试剂和溶剂如无特殊说明,均为分析纯或化学纯.
溶剂 DCM DMF DMSO THF THF THF THF THF THF 碱 Et3N Et3N Et3N Et3N Pyridine DMAP K2CO3 Cs2CO3 NaH 反应时间/h 5 1.5 1.5 2 3 3 2 1.5 1 收率/% 54 78 75 78 47 64 70 72 83 表 1 溶剂及碱对合成目标化合物的影响
Table 1. The influence of solvent and base on the yield of the product 表 2
化合物对猪心复合物Ⅲ的抑制活性
Table 2.
Inhibitory activity of the synthesized compounds against porcine SCR cyt bc1
表 2
化合物对猪心复合物Ⅲ的抑制活性
Table 2.
Inhibitory activity of the synthesized compounds against porcine SCR cyt bc1

化合物 R 抑制率/% IC50/(μmol•L-1) 6a H 35 — 6b 6-F <10 — 6c 6-Br 24 — 6d 6-Cl 22 — 6e 6-Me 30 — 6f 8-Me 59 45.75±1.02 6g 6,8-Me2 <10 — 6h 7,8-Me2 18 — 6i 6-Cl-8-Me 35 — 6j 5-Cl-8-Me 25 — 6k 7-Cl-8-Me <10 — 6l 6-F-8-Cl <10 — 6m 6-F-8-Br <10 — 6n 5,8-F2 27 — Amisulbrom — 45 92.96±1.30 表 2 化合物对猪心复合物Ⅲ的抑制活性
Table 2. Inhibitory activity of the synthesized compounds against porcine SCR cyt bc13.2 活性测试方法
琥珀酸-细胞色素c氧化还原酶中泛醌-细胞色素c氧化还原酶(细胞色素bc1复合体),即线粒体复合体Ⅲ (QCR)的活性测定方法为[11]: 于-20 ℃冰箱取出冻存的底物DBH2和cytochrome c,室温融化. 于-80 ℃冰箱取出分装冻存的酶,加预冷的Na2HPO4-NaH2PO4缓冲液稀释至浓度为18 nmol/L,冰上放置. 洗净3 mL的石英比色皿,在总体积为1. 8 mL的测活体系中依次加入900 μL 0.2 mol/L的Na2HPO4-NaH2PO4缓冲液(pH 6.5)至终浓度为100 mmol/L、120 μL 30 mmol/L的EDTA至终浓度为2 mmol/L、180 μL 1 mmol/L的cytochrome c至终浓度为100 μmol/L,9 μL 12 mmol/L的DBH2至终浓度为60 μmol/L、13.5 μL 0.1 mol/L的去污剂lauryl maltoside (n-dodecyl-β-D-maltoside)至终浓度为750 μmol/L,加水补齐体积至1795 μL. 其中,DBH2是由DB通过还原制备而得,而DBH2十分容易自氧化,因此未加酶时,两个底物就会发生非酶反应,该反应能被一种膜蛋白去污剂lauryl maltoside所抑制,并且在pH 6.5的Na2HPO4-NaH2PO4缓冲液中本底反应最低,即能监测到最大的泛醌-细胞色素c氧化还原酶活力. 因此在23 ℃恒温水浴及600 r/min的磁力搅拌条件下,开始监测,基线走平加入容易自氧化的底物DBH2开始记录100 s,此时斜率表示的是非酶反应速率. 加5 μL已经事先稀释至18 nmol/L的酶启动反应,则体系中酶浓度为0.05 nmol/L,反应5 min,也是在波长为550 nm处监测底物cytochrome c光吸收的增加,采集线性范围内的实验点,控制底物消耗不超过5%. cytochrome c的摩尔消光系数为18.5 mL•mol-1•cm-1. 计算在反应时间内cytochrome c的还原产量并拟合线性斜率,再扣掉非酶反应的斜率值得到的数据即为反应的初速度.
用紫外分光度计测定在饱和的底物浓度下,不同浓度的抑制剂对酶的反应动力学. 参比: 空气或者所用buffer对照: 在1.8 mL体系中加入底物和2 μL DMSO,加酶启动反应,测定没有抑制剂时酶的全活性. 样品: 改变抑制剂的浓度,监测抑制剂对酶活性的影响. 数据处理: 根据朗伯比尔定律,将吸光度转换为产物浓度,再对时间线性拟合得到初速度. 将样品与对照相比算出抑制率,IC50值根据下面的公式拟合得到:
公式中: y为对应浓度抑制剂下酶的残留活性与未加抑制剂活性的百分比,max、min为S形曲线的上、下两个平台,相对活性的最大值和最小值,x为对应抑制剂浓度,IC50为残留活性为50%时的抑制剂浓度.
辅助材料(Supporting Information) 目标化合物6a~6n的1H NMR、13C NMR和MS原始图谱. 这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载
3.2 实验方法
3.2.4 中间体4的合成
称取22.40 g碳酸钾,加入68 mL水,待碳酸钾完全溶解并恢复室温时,加入6 g相应的苯胺,然后缓慢滴加7.28 g肉桂酰氯溶于34.8 mL丙酮的溶液,滴加时间为1 h,常温搅拌,反应完全后,静置,抽滤,水洗,石油醚洗涤,得白色固体,干燥得中间体4a~4n.
3.2.1 中间体1的合成
在氮气保护的条件下,将3.03 g三氮唑巯基化合物溶于15 mL干燥二氯甲烷中,加入2.37 g干吡啶,在冰浴条件下慢慢滴加2.64 g苯磺酰氯,滴加时间约为1 h,滴加完毕后移去冰浴,在常温条件下反应16 h,反应完全后,蒸去二氯甲烷,将剩余物在搅拌条件下加入15 mL水和9 mL乙醇,反应1 h,过滤,再用6 mL水和6 mL乙醇洗涤两次,得到白色固体,在60~70 ℃条件下真空干燥得到二硫化物1,收率92%[19].
3.2.6 目标物6的合成
将0.223 g上步产物和0.08 g NaH (纯度为60%)在重蒸的THF里搅拌1 h,加入0.27 g中间体3,反应完全后,水洗,用二氯甲烷仿萃取,无水硫酸钠干燥,柱层析得到目标化合物6a~6n.
3-(2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H- 1,2,4-三唑-1-磺酰胺(6a): 白色固体,产率83%. m.p. 110~112 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 9.60 (s,1H,N-CH),8.66 (d,J=8.4 Hz,1H,Ar-H),8.10 (d,J=7.8 Hz,1H,Ar-H),7.83 (d,J=7.2 Hz,1H,Ar-H),7.71~7.67 (m,2H,Ar-H),7.51 (d,J=8.0 Hz,1H,Ar-H),2.92 (s,6H,2N-CH3); 13C NMR (100 MHz,CDCl3) δ: 159.56,154.10,148.43,144.06,130.82,138.82,134.94,130.81,127.48,126.73,124.22,114.12,38.33; EI-MS m/z: 383.29 (M+). Anal. calcd for C13H13N5O5S2: C 40.72,H 3.42,N 18.27,S 16.73; found C 40.89,H 3.322,N 18.14,S 16.56.
3-(6-氟-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲 基-1H-1,2,4-三唑-1-磺酰胺(6b): 白色固体,产率56%. m.p. 154~156 ℃; 1H NMR (400 MHz,DMSO-d6) δ: 9.62 (s,1H,N-CH),8.63 (d,J=9.0 Hz,1H,Ar-H),8.42 (s,1H,Ar-H),7.96 (d,J=9.0 Hz,1H,Ar-H),7.63~7.62 (m,1H,Ar-H),7.58~7.59 (m,1H,Ar-H),2.93 (s,6H,2N-CH3); 13C NMR (100 MHz,DMSO-d6) δ: 161.38,159.11,153.86,141.75,135.28,127.95,122.88,119.67,118.12,116.86,38.41; EI-MS m/z: 401.28 (M+). Anal. calcd for C13H12FN5O5S2: C 38.90,H 3.01,N 17.45,S 15.98; found C 39.07,H 2.877,N 17.66,S 16.23.
3-(6-溴-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲 基-1H-1,2,4-三唑-1-磺酰胺(6c): 白色固体,产率63%. m.p. 168~169 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 9.59 (s,1H,N-CH),8.62 (d,J=8.4 Hz,1H,Ar-H),8.41 (s,1H,Ar-H),7.95 (d,J=8.4 Hz,1H,Ar-H),7.62 (d,J=8.4 Hz,1H,Ar-H),7.57 (d,J=8.4 Hz,1H,Ar-H),2.93 (s,6H,2N-CH3); 13C NMR (100 MHz,DMSO-d6) δ: 160.86,158.37,152.04,147.65,145.48,139.53,129.44,127.08,126.97,122.08,120.39,115.02,111.72,38.27; EI-MS m/z: 462.25 (M+). Anal. calcd for C13H12BrN5O5S2: C 33.77,H 2.62,N 15.15,S 13.87; found C 34.02,H 2.750,N 14.94,S 13.71.
3-(6-氯-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲 基-1H-1,2,4-三唑-1-磺酰胺(6d): 白色固体,产率60%. m.p. 153~155 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 9.61 (s,1H,N-CH),8.63 (d,J=9.0 Hz,1H,Ar-H),8.26 (s,1H,Ar-H ),7.85 (d,J=9.6Hz,1H,Ar-H),7.70 (d,J=9.0 Hz,1H,Ar-H),7.59 (d,J=8.4 Hz,1H,Ar-H),2.94 (s,6H,2N-CH3); 13C NMR (100 MHz,DMSO-d6) δ: 159.38,154.77,148.81,143.38,141.87,125.50,131.83,131.73,129.66,127.97,126.94,115.17,38.32; EI-MS m/z: 417.07 (M+). Anal. calcd for C13H12ClN5O5S2: C 37.37,H 2.89,N 16.76,S 15.35; found C 37.66,H 2.716,N 16.46,S 15.60.
3-(6-甲基-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6e): 白色固体,产率82%. m.p. 148~150 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 8.72 (s,1H,N-CH),8.18 (d,J=9.6 Hz,1H,Ar-H),7.63~7.60 (m,2H,Ar-H),7.53 (d,J=8.4 Hz,1H,Ar-H),7.27 (d,J=8.4 Hz,1H,Ar-H),3.03 (s,6H,2N-CH3),2.52 (s,3H,CH3); 13C NMR (100 MHz,DMSO-d6) δ: 154.99,149.45,144.26,138.87,137.21,132.73,128.84,122.90,122.76,122.35,109.45,33.80,16.51; EI-MS m/z: 397.19 (M+). Anal. calcd for C14H15N5O5S2: C 42.31,H 3.80,N 17.62,S 16.14; found C 42.13,H 3.636,N 17.72,S 15.99.
3-(8-甲基-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6f): 白色固体,产率76%. m.p. 119~120 ℃; 1H NMR (400 MHz,CDCl3) δ: 8.72 (s,1H,N-CH),8.24 (d,J=8.8 Hz,1H,Ar-H),7.66 (d,J=7.6 Hz,1H,Ar-H),7.52 (d,J=6.4 Hz,1H,Ar-H),7.41~7.45(m,1H,Ar-H),7.27 (d,J=8.8 Hz,1H,Ar-H),3.04 (s,6H,2N-CH3),2.38 (s,3H,CH3); 13C NMR (100 MHz,CDCl3) δ: 161.22,154.22,146.27,144.47,141.60,136.44,130.80,127.12,126.77,125.2 8,112.75,38.72,17.20; EI-MS m/z: 397.33 (M+). Anal. calcd for C14H15N5O5S2: C 42.31,H 3.80,N 17.62,S 16.14; found C 42.59,H 3.755,N 17.39,S 16.37.
3-(6,8-二甲基-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6g): 白色固体,产率86%. m.p. 134~136 ℃; 1H NMR (400 MHz,CDCl3) δ: 8.73 (s,1H,N-CH),8.13 (d,J=8.8 Hz,1H,Ar-H),7.41 (s,1H,Ar-H),7.36 (s,1H,Ar-H),7.21 (d,J=8.8 Hz,1H,Ar-H),2.61 (s,6H,2N-CH3),2.45 (s,3H),2.33 (s,3H,CH3); 13C NMR (150 MHz,DMSO-d6) δ: 161.27,153.77,146.26,143,07,140.85,136.81,136.10,133.15,127.34,124.22,112.81,38.82,21.43,17.13; EI-MS m/z: 411.03 (M+); Anal. calcd for C15H17N5O5S2: C 43.79,H 4.16,N 17 .02,S 15.59; found C 43.90,H 4.072,N 16.74,S 15.38.
3-(7,8-二甲基-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6h): 白色固体,产率86%. m.p. 118~119 ℃; 1H NMR (400 MHz,CDCl3) δ: 8.71 (s,1H,N-CH),8.18 (d,J=8.4 Hz,1H,Ar-H),7.56 (d,J=8.0 Hz,1H,Ar-H),7.35 (d,J=8.4 Hz,1H,Ar-H),7.17 (d,J=8.4 Hz,1H,Ar-H),3.04 (s,6H,2N-CH3),2.44 (s,3H,CH3),2.31 (s,3H,CH3); 13C NMR (100 MHz,CDCl3) δ: 161.38,154.42,146.22,144.59,141.44,139.02,133.99,129.84,125.60,124.36,111.65,38.85,20.58,12.94; EI-MS m/z: 411.29 (M+). Anal. calcd for C15H17N5O5S2: C 43.79,H 4.16,N 17.02,S 15.59; found C 43.94,H 4.045,N 16.83,S 15.83.
3-(6-氯-8-甲基-2(1H)-氧亚基喹啉-1-基磺酰基)- N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6i): 白色固体,产率64%. m.p. 148~150 ℃; 1H NMR (600 MHz,CDCl3) δ: 9.62 (s,1H,N-CH),8.60 (d,J=8.0 Hz,1H,Ar-H),8.05 (s,1H,Ar-H),7.72 (s,1H,Ar-H),7.6 (d,J=8.0 Hz,1H,Ar-H),2.95 (s,6H,2N-CH3),2.26 (s,3H,CH3); 13C NMR (100 MHz,DMSO-d6) δ: 159.62,153.94,144.18,142.08,137.93,131.12,127.58,124.33,114.26,38.36,16.56; EI-MS m/z: 431.08 (M+). Anal. calcd for C14H14ClN5O5S2: C 38.93,H 3.27,N 16.22,S 14.85; found C 38.79,H 3.055,N 16.59,S 14.57.
3-(5-氯-8-甲基-2(1H)-氧亚基喹啉-1-基磺酰基)- N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6j): 白色固体,产率68%. m.p. 150~152 ℃; 1H NMR (600 MHz,CDCl3) δ: 9.63 (s,1H,N-CH),8.79~8.77 (m,1H,Ar-H),7.73 (d,J=8.6 Hz,1H,Ar-H),7.69~7.65 (m,2H,Ar-H),2.96 (s,6H,2N-CH3),2.26 (s,3H,CH3); 13C NMR (100 MHz,DMSO-d6) δ: 162.22,158.36,144.24,140,67,136.85,131.41,126.80,125.61,124.64,122.67,120.36,37.37,23.68; EI-MS m/z: 431.26 (M+). Anal. calcd for C14H14ClN5O5S2: C 38.93,H 3.27,N 16.22,S 14.85; found C 38.69,H 3.055,N 15.99,S 15.17.
3-(7-氯-8-甲基-2(1H)-氧亚基喹啉-1-基磺酰基)- N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6k): 白色固体,产率76%. m.p. 143~145 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 9.62 (s,1H,N-CH),8.67 (d,J=8.4 Hz,1H,Ar-H),7.95 (d,J=8.4 Hz,1H,Ar-H),7.70 (d,J=8.4 Hz,1H,Ar-H),7.57 (d,J=8.4 Hz,1H,Ar-H),2.94 (s,6H,2N-CH3),2.33 (s,3H,CH3); 13C NMR (100 MHz,DMSO-d6) δ: 159.50,154.33,148.30,143.69,135.10,132.60 ,127.69,126.32,125.42,113.07,38.27,13.66; EI-MS m/z: 431.13 (M+). Anal. calcd for C14H14ClN5O5S2: C 38.93,H 3.27,N 16.22,S 14.85; found C 38.99,H 3.7055,N 16.49,S 14.57.
3-(8-氯-6-氟-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6l): 白色固体,产率53%. m.p. 168~170 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 9.62 (s,1H,N-CH),8.72 (d,J=8.0 Hz,1H,Ar-H),8.09 (d,J=6.6 Hz,1H,Ar-H),7.96 (d,J=8.0 Hz,1H,Ar-H),7.71 (d,J=8.0 Hz,1H,Ar-H),2.95 (s,6H,2N-CH3); 13C NMR (100 MHz,DMSO-d6) δ: 159.78,159.28,157.32,154.34,148.36,142.67,138.08,132.20,128.20,121.04 ,115.64,38.26; EI-MS m/z: 435.10 (M+). Anal. calcd for: C13H11ClFN5O5S2: C 35.83,H 2.54,N 16.07,S,14.71; found C 36.12,H 2.393,N 16.27,S 14.46.
3-(8-溴-6-氟-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6m): 白色固体,产率50%. m.p. 185~187 ℃; 1H NMR (400 MHz,DMSO-d6) δ: 8.72 (s,1H,N-CH),8.25 (d,J=8.8 Hz,1H,Ar-H),7.80 (d,J=7.6 Hz,1H,Ar-H),7.45 (d,J=8.0 Hz,1H,Ar-H ),7.37 (d,J=8.8 Hz,1H,Ar-H),3.07 (s,6H,2N-CH3); 13C NMR (150 MHz,DMSO-d6) δ: 159.95,159.23,157.47,154.48,148.39,142.83,139,08,128.05,123.02,115.5 2,111.39,38.29; EI-MS m/z: 479.03 (M+). Anal. calcd for C13H11BrFN5O5S2: C 32.51,H 2.31,N 14.58,S 13.35; found C 32.66,H 2.604,N 14.76,S 13.57.
3-(5,8-二氟-2(1H)-氧亚基喹啉-1-基磺酰基)-N,N-二甲基-1H-1,2,4-三唑-1-磺酰胺(6n): 白色固体,产率43%. m.p. 172~174 ℃; 1H NMR (400 MHz,DMSO-d6) δ: 9.65 (s,1H,N-CH),8.79 (d,J=9.2 Hz,1H,Ar-H),7.75~7.69 (m,2H,Ar-H),7.56~7.51 (m,1H,Ar-H),2.98 (s,6H,2N-CH3); 13C NMR (100 MHz,CDCl3) δ: 159.10,155.14,153.87,151.36,148.52,134.45,123.53,115.45,111.07,38.28; EI-MS m/z: 419.22 (M+). Anal. calcd for C13H11F2N5O5S2: C 37.23,H 2.64,N 16.70,S 15.29; found C 37.33,H 2.470,N 16.74,S 15.38.
3.2.3 中间体3的合成
上步中间体2.00 g溶于25%醋酸水溶液中,5 ℃下通入氯气,反应时间0.5 h,静置,抽滤得中间体3,收率91.1%[17].
3.2.5 中间体5的合成
称取10.48 g上步产物,和7 mL氯苯混合,搅拌均匀后回流,加入27.70 g AlCl3 (无水),待反应完全后,除去多余氯苯,再将剩余物质倒入冰水中,抽滤,得棕色固体,用甲醇重结晶,得到中间体5a~5n.
喹啉-2(1H)-酮(5a): 白色固体,产率89%. m.p. 199~200 ℃; 1H NMR (400 MHz,DMSO-d6) δ: 12.70 (s,1H,NH),7.83 (d,J=9.6 Hz,1H,Ar-H),7.59~7.56 (m,1H,Ar-H),7.52~7.50 (m,1H,Ar-H),7.31 (d,J=7.6 Hz,1H,Ar-H),6.73 (d,J=9.6 Hz,1H,Ar-H),EI-MS m/z: 145.92 (M+).
6-氟喹啉-2(1H)-酮(5b): 白色固体,产率54%. m.p. 270~271 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.84 (s,1H,NH),7.88 (d,J=9.6 Hz,1H,Ar-H),7.55 (d,J=8.0 Hz,1H,Ar-H),7.40 (d,J=4.8 Hz,1H,Ar-H),7.31 (d,J=7.8 Hz,1H,Ar-H),6.57 (d,J=9.6 Hz,1H,Ar-H); EI-MS m/z: 163.92 (M+).
6-溴喹啉-2(1H)-酮(5c): 白色固体,产率74%. m.p. 268~269 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.89 (s,1H,NH),7.93 (s,1H,Ar-H),7.88 (d,J=9.6 Hz,1H,Ar-H),7.65 (d,J=6.0 Hz,1H,Ar-H),7.25 (d,J=9.0 Hz,1H,Ar-H),6.56 (d,J=9.6 Hz,1H,Ar-H); EI-MS m/z: 222.93 (M+).
6-氯喹啉-2(1H)-酮(5d): 白色固体,产率70%. m.p. 267~268 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.90 (s,1H,NH),7.89 (d,J=9.0 Hz,1H,Ar-H),7.80 (s,1H,Ar-H),7.54 (d,J=8.4 Hz,1H,Ar-H),7.31 (d,J=9.0 Hz,1H,Ar-H),6.57 (d,J=9.6 Hz,1H,Ar-H); EI-MS m/z: 179.84 (M+).
6-甲基喹啉-2(1H)-酮(5e): 白色固体,产率80%. m.p. 233~234 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.68 (s,1H,NH),7.80 (d,J=8.0 Hz,1H,Ar-H),7.43 (s,1H,Ar-H),7.31 (d,J=8.8 Hz,1H,Ar-H),7.20 (d,J=7.2 Hz,1H,Ar-H),6.46 (d,J=9.6 Hz,1H,Ar-H),2.32 (s,3H,CH3); EI-MS m/z: 159.74 (M+).
8-甲基喹啉-2(1H)-酮(5f): 白色固体,产率82%. m.p. 219~220 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 10.93 (s,1H,NH),7.90 (d,J=9.6 Hz,1H,Ar-H),7.50 (d,J=9.6 Hz,1H,Ar-H ),7.35 (d,J=7.8 Hz,1H,Ar-H),7.10 (d,J=7.8 Hz,1H,Ar-H),6.51 (d,J=7.8 Hz,1H,Ar-H),2.42 (s,3H,CH3); EI-MS m/z: 159.36 (M+).
6,8-二甲基喹啉-2(1H)-酮(5g): 白色固体,产率86%. m.p. 228~230 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.20 (s,1H,NH),7.94 (d,J=9.6 Hz,1H,Ar-H),7.75 (d,J=8.0 Hz,1H,Ar-H),7.63 (d,J=8.4 Hz,1H,Ar-H),6.67 (d,J=9.6 Hz,1H,Ar-H),2.47 (s,3H,CH3),2.81 (s,3H,CH3); EI-MS m/z: 173.53 (M+).
7,8-二甲基喹啉-2(1H)-酮(5h): 白色固体,产率80%. m.p. 198~200 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 10.79 (s,1H,NH),7.84 (d,J=9.0 Hz,1H,Ar-H),7.40 (d,J=7.2 Hz,1H,Ar-H),7.03 (d,J=7.8 Hz,1H,Ar-H),6.44 (d,J=9.6 Hz,1H,Ar-H),2.34 (s,3H,CH3),2.32 (s,3H,CH3); EI-MS m/z: 173.58 (M+).
6-氯-8-甲基喹啉-2(1H)-酮(5i): 白色固体,产率73%. m.p. 176~178 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.08 (s,1H,NH),7.88 (d,J=9.6 Hz,1H,Ar-H),7.65 (s,1H,Ar-H),7.35 (d,J=8.0 Hz,1H,Ar-H),6.57 (d,J=9.6Hz,1H,Ar-H),2.38 (s,3H,CH3); EI-MS m/z: 193.95 (M+).
7-氯-8-甲基喹啉-2(1H)-酮(5k): 白色固体,产率64%. m.p. 236~238 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 11.08 (s,1H,NH),7.91 (d,J=8.0 Hz,1H,Ar-H),7.53 (d,J=7.2 Hz,1H,Ar-H),7.25 (d,J=7.8 Hz,1H,Ar-H),6.53 (d,J=8.0 Hz,1H,Ar-H),2.47 (s,3H,CH3); EI-MS m/z: 193.96 (M+).
8-氯-6-氟喹啉-2(1H)-酮(5l): 白色固体,产率47%. m.p. 220~222 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 10.67 (s,1H,NH),7.93 (d,J=9.6 Hz,1H,Ar-H),7.88 (d,J=8.0 Hz,1H,Ar-H),7.66 (d,J=8.0 Hz,1H,Ar-H),6.67 (d,J=8.4Hz,1H,Ar-H); EI-MS m/z: 197.67 (M+).
8-溴-6-氟喹啉-2(1H)-酮(5m): 白色固体,产率50%. m.p. 221~223 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 10.67 (s,1H,NH),7.93 (d,J=9.6 Hz,1H,Ar-H),7.88 (d,J=8.0 Hz,1H,Ar-H),7.66 (d,J=8.0 Hz,1H,Ar-H),6.67 (d,J=8.4Hz,1H,Ar-H); EI-MS m/z: 240.947 (M+).
5,8-二氟喹啉-2(1H)-酮(5n): 白色固体,产率44%. m.p. 233~235 ℃; 1H NMR (600 MHz,DMSO-d6) δ: 12.05 (s,1H,NH),7.99 (d,J=8.4 Hz,1H,Ar-H),7.45 (d,J=6.4 Hz,1H,Ar-H),7.02 (d,J=8.4 Hz,1H,Ar-H),6.64 (d,J=9.6 Hz,1H,Ar-H); EI-MS m/z: 181.46 (M+).
3.2.2 中间体2的合成
上步产物0.52 g投入到0.90 g碳酸钾的DMF溶液中,搅拌1 h后,冰浴条件下缓慢滴加0.37 g N,N-二甲基磺酰氯,反应完全后,加入大量的水,二氯甲烷萃取,无水硫酸钠干燥,蒸去溶剂得无色油状物,加入少量甲醇,即析出大量白色固体,抽滤干燥,得中间体2,收率90%[20].
-
-
[1]
(1) Sun, F.; Zhou, Q. J.; Sun, J.; Zhai, Y. J.; Rao, Z. H. Bull. Life Sci.2008, 20(4), 566 (in Chinese). (孙飞, 周强军, 孙吉, 翟宇佳, 饶子和, 生命科学, 2008, 20(4), 566.)
-
[2]
Zhang, Z. L.; Lishar, H.; Shulmeister, V. M.; Chi, Y. I.; Kyeong, K. K.; Hung, L. W.; Crofts, A. R.; Berry, E. A.; Kim, S. H. Nature 1998, 392, 677. doi: 10.1038/33612
-
[3]
Iwata, S.; Lee, J. W.; Okada, K.; Lee, J. K.; Iwata, M.; Rasmussen, B.; Link, T. A.; Ramaswamy, S. Science 1998, 281, 64.
-
[4]
Hunte, C.; Koepke, J.; Lange, C.; Romanith, T.; Michel, H. Structure 2000, 8(6), 669.
-
[5]
Gao, X. G; Wen, X. L.; Esser, L.; Quinn, B.; Yu, L. D.; Yu, C. A.; Xia, D. Biochemistry 2003, 42(30), 9067. doi: 10.1021/bi0341814
-
[6]
Esser, L.; Quinn, B.; Li, Y. F.; Zhang, M. M.; Elberry, L.; Yu, C. A.; Xia, D. J. Mol. Biol. 2004, 341(1), 281. doi: 10.1016/j.jmb.2004.05.065
-
[7]
Huang, L.; Cobessi, D.; Tung, E. Y.; Berry, E. A. J. Mol. Biol. 2005, 351(3), 573. doi: 10.1016/j.jmb.2005.05.053
-
[8]
Yang, W. C.; Li, H.; Wang, F.; Zhu, X. L.; Yang, G. F. ChemBioChem 2012, 13(11), 1542. doi: 10.1002/cbic.v13.11
-
[9]
Maklashina, E.; Cecchini, G. Biochim. Biophys. Acta 2010, 1797(12), 1877.
-
[10]
Li, H.; Zhu, X. L.; Yang, W. C.; Yang, G. F. Chem. Biol. Drug. Des. 2014, 83(1), 71. doi: 10.1111/cbdd.12199
-
[11]
Cheng, H.; Shen, Y. Q.; Pan, X. Y.; Hou, Y. P.; Wu, Q. Y.; Yang, G. F. New J. Chem. 2015, 39(9), 7281. doi: 10.1039/C5NJ00215J
-
[12]
Tang, J. L.; Xu, J. G.; Song, J.; Guang, L.; Chen, L. J. Guangdong Pharm. Univ. 2013, 29(6), 596 (in Chinese). (汤洁丽, 许俊耿, 宋健, 关丽, 陈琳, 广东药学院学报, 2013, 29(6), 596.)
-
[13]
Harper, S.; Avolio, S. J. Med. Chem. 2005, 48(2), 547. doi: 10.1021/jm0494974
-
[14]
Oshiro, Y.; Sam, S. J. Med. Chem. 1998, 41(5), 658. doi: 10.1021/jm940608g
-
[15]
Salmon, R.; Mitchell, G.; Morris, J. A. WO 2010116122, 2010[Chem. Abstr. 2010, 153, 470191].
-
[16]
Yang, J. Q.; Hu, Y. W.; Gu, Q.; Li, M. G.; Li, M. Q.; Song, B. A. Chin. J. Org. Chem. 2014, 34, 829. (in Chinese) (杨家强, 胡月维, 谷晴, 李明刚, 李明强, 宋宝安, 有机化学, 2014, 34, 829.)
doi: 10.6023/cjoc201311027 -
[17]
Mahieu, J. P.; Gosselet, M.; Sebille, B.; Beuzard, Y. Synth. Commun. 1986, 16(13), 1709.
-
[18]
Manimaran, T.; Thiruvengadam, T. K.; Ramakrishnan, V. T. Synth. Commun. 1975, 11, 739.
-
[19]
Hegde, S. G.; Mahoney, M. D. WO 2000042028, 2000[Chem. Abstr.2000, 133, 105038].
-
[20]
Fukuda, K.; Kondo, Y.; Makabe, T.; Tanaka, N.; Utsunomiya, T.; Sakurai, Y. WO 2006057354, 2006[Chem. Abstr.2006, 145, 27993].
-
[1]
-
表 1 溶剂及碱对合成目标化合物的影响
Table 1. The influence of solvent and base on the yield of the product
溶剂 DCM DMF DMSO THF THF THF THF THF THF 碱 Et3N Et3N Et3N Et3N Pyridine DMAP K2CO3 Cs2CO3 NaH 反应时间/h 5 1.5 1.5 2 3 3 2 1.5 1 收率/% 54 78 75 78 47 64 70 72 83 表 2 化合物对猪心复合物Ⅲ的抑制活性
Table 2. Inhibitory activity of the synthesized compounds against porcine SCR cyt bc1

化合物 R 抑制率/% IC50/(μmol•L-1) 6a H 35 — 6b 6-F <10 — 6c 6-Br 24 — 6d 6-Cl 22 — 6e 6-Me 30 — 6f 8-Me 59 45.75±1.02 6g 6,8-Me2 <10 — 6h 7,8-Me2 18 — 6i 6-Cl-8-Me 35 — 6j 5-Cl-8-Me 25 — 6k 7-Cl-8-Me <10 — 6l 6-F-8-Cl <10 — 6m 6-F-8-Br <10 — 6n 5,8-F2 27 — Amisulbrom — 45 92.96±1.30 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1093
- HTML全文浏览量: 173





 下载:
下载:



 下载:
下载:

