1. 东北师范大学附属中学 吉林长春 130021;
2. 东北师范大学化学学院 吉林长春 130024
1. High School Attached to Northeast Normal University, Changchun 130021, China;
2. Faculty of Chemistry, Northeast Normal University, Changchun 130024, China
化学新课程的实施,尤其是学科性、理论性渐强的选修模块,对教师驾驭学科的能力提出了严峻的挑战。例如,在“化学反应原理”中的“化学反应进行的方向”一节,从高中生的角度,仅要求能用焓变和熵变说明化学反应的方向,但其背后却蕴含着比较深奥的学科知识,甚至在大学教学中也对自发过程的概念、判据等存在争议。因此作为教师,需要深刻理解其内涵,把握知识的本质,将其深入浅出地传授给学生。
1 自发过程的概念
【问】在中学教材中[1]对自发过程的描述是:“不借助外力就可以自动进行的过程……”,此处的“外力”具体指什么?
【答】此处的“外力”即外来作用,是指环境对体系(系统)做功。功的概念最初来源于机械功,它等于力与力方向位移的乘积。从微观上讲,功是大量质点以有序运动而传递的能量。功的形式包括体积功(膨胀功)和非体积功(也称非膨胀功或其他功,例如电功、表面功、机械功、光能等)。
因此按学科的语言,自发过程可以这样定义[2]:“体系不需要从环境得到功就可以进行的过程”,而非自发过程可定义为:“体系需要从环境得到功才能进行的过程”。
【问】氢氧混合气体可以长时间不发生化学反应,需要用火花或加入催化剂才能引发反应,那么所用的火花或催化剂为什么不属于“外力”?又如,在高温下加热可以使稳定的石灰石分解,环境只提供了热量,并未做功,这里所说的高温为什么说属于“外力”?
【答】过程自发与否(自发性)只由体系的始、终状态决定(内因),不会因环境干预而改变。众所周知,氢氧化合生成水是自发过程,上述的“火花”或“催化剂”不属于“外力”,属于使反应得以进行的诱发条件。因为热力学理论所预言的自发过程仅代表变化方向的一种可能性,并不意味着无条件实现,还有一个速率问题。有时使自发过程进行时,需提供反应所需的活化能。然而热力学理论对非自发过程的预言是十分肯定的,例如水分解生成氢气和氧气不从环境得到功(如电解或光解)是肯定无法实现的。
通常判断环境所施加的条件是否属于“外力”的方法是,在反应进行过程中,当撤除这一“外力”时,看反应能否继续进行。如果能继续进行,则不属于“外力”;如果不能继续进行,则属于“外力”。
在室温下,石灰石的分解是非自发变化,通过加热使其分解的过程表示如下:
从表面上看,实现上述变化,环境并未对反应体系做功。然而环境提供了2个热源,即加热CaCO3 ( s)的高温热源和把产物CaO ( s)、CO2 ( g)降温的低温热源。环境最终变化的结果是,高温热源失去一部分热量后传递给低温热源,这相当于开启了一台热机,环境最终失去了一些做功能力(提供外力)。
因此,判断A→B过程是否为自发,关键在于该过程进行以后,环境最终是否消耗了功。如果环境最终是消耗了功,则过程为非自发。否则为自发。
【问】为什么说自发过程的逆过程一定是非自发过程?
【答】自发过程与非自发过程互为逆过程。即在指定的状态A和状态B之间,若A→B为自发过程,则B→A必为非自发过程;反之,若A→B为非自发过程,则B→A必为自发过程。
因为在指定的状态A和状态B之间,客观上存在一个判别过程自发性的状态函数 X ,若A→B时Δ X >0,则B→A时Δ X<0。状态函数的性质决定了过程自发性具有互为正、反的性质。
【问】自然界发生(无人为干预)的过程都是自发过程吗?
【答】本问牵涉一个问题是:在讨论过程的自发性时,首先必须明确体系与环境的划分。体系不确定,过程的自发性无从谈起。本问必须指明体系是自然界中的哪部分。例如,植物的光合作用是自然界发生的过程,如果仅以反应:CO2 +H2O → 有机物+O2为体系时,过程为非自发;如果体系囊括太阳,则过程为自发。
又如,用一个原电池驱动一个电解池,若以原电池为体系,则过程为自发;若以电解池为体系,则过程为非自发;若以原电池和电解池为体系,则过程为自发。
由此可见,自然界中局部发生的非自发过程都是在一个比它强大的自发过程驱动下,进行着一个大体系的自发过程。
【问】“实现非自发过程的先决条件是要向体系中输入能量”。这种说法对否?
【答】这种说法不准确,严格地说,“……是要向体系输入功。”这里所说的功,是指过程进行中,体系与环境交换的一种能量(另一种形式为热)。体系中的大量粒子作有规则的定向运动时,交换的能量才表现为功。即功与有规则的运动相联系,而热与无规则的运动相联系,热力学之所以把交换的能量区分为热和功,其意义在于热和功转化存在着不可逆性,热和功的微观差异正是反映了热力学第二定律的本质[3]。
【问】自发过程进行时一定对环境做功(提供外力)?
【答】自发过程进行时,可以对环境做功,也可以不对环境做功,做功与否取决于对过程的安排和设计。例如,氢氧化合生成水,安排在等容条件下进行,则不对环境做功,如果设计成原电池完成反应,则对环境做电功。自发过程具有做功的能力,但不一定要在过程中表现出来。原则上讲,可以由任何的自发变化获得可利用的功。
由于非自发过程进行时需要环境做功,所以体系进行非自发过程时,将获得一定的做功能力。显然,非自发过程进行时,环境所做的功只能由其他的自发过程所提供。因此,一个自发过程只有在被其他自发过程以某种方式做功推动时,才可能逆向进行[4]。
2 自发过程的方向和限度
【问】查表得知,室温下,碳酸氢铵分解成氨气、水和二氧化碳为非自发反应(Δr Gθ m ( 298 K)=29.232 kJ·mol-1)。但是取碳酸氢铵时,立刻就嗅到氨臭,说明碳酸氢铵自发分解了。如何解释?
【答】本问涉及一个问题就是:在讨论过程自发性时,必须指定过程的始态和终态。
这个问题常被忽视。我们说,室温下碳酸氢铵分解成氨气、水和二氧化碳为非自发反应,是指在25 ℃反应:NH4HCO3 ( s,pθ)→NH3 ( g,pθ)+H2O ( g,pθ)+CO2 ( g,pθ)
为非自发。也就是碳酸氢铵自发分解成 pθ压力下的氨气、水和二氧化碳是不可能的。经计算得知,25 ℃时氨气的平衡分压为p( NH3) =1.96×103 Pa。而“立刻就嗅到氨臭”,只说明碳酸氢铵分解成低压(分压 p<1.96×103 Pa)下的气体产物:
NH4HCO3 ( s,pθ)→NH3 ( g,p )+H2O ( g,p )+CO2 ( g,p )是自发的。
又如,笼统地问:碳酸钙的分解是否为自发?难以回答。因为在25 ℃、 pθ下,CaCO3 ( s)分解成CaO ( s)、CO2 ( g)为非自发过程;而在900 ℃、 pθ下,CaCO3 ( s)分解则成为自发过程。
【问】自发过程有什么共同特点?
【答】 自发过程不需要环境做功就可以进行,而非自发过程必须有环境做功才能进行,这是2者最本质的区别。自发变化的共同特点是:(1) 具有一定的方向和限度;(2) 具有做功的能力。表 1归纳了几类自发过程的共同特点。
表 1中化学反应亲和势的定义是[5]:$A=\sum\limits_{B}{{{\nu }_{B}}{{\mu }_{B}}}$。即 A 是反应物的化学势之和减去产物的化学势之和。将化学反应与简单的物理过程对比,有助于对化学反应方向和限度的理解。
表 1
Table 1
表 1(Table 1)
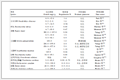
表 1 自发过程举例
Table 1 Examples of spontaneous process
| 自发过程 | 变化方向 | 限度 | 做功的能力 |
| 水流 | 高水位→低水位 | 相同水位 | 发电 |
| 气流 | 高气压→低气压 | 相同压强 | 做膨胀功 |
| 电流 | 高电势→低电势 | 相同电势 | 电功 |
| 热传导 | 高温→低温 | 相同温度 | 带动热机 |
| 化学反应 | 高化学反应亲和势→低化学反应亲和势 | 化学平衡状态 | 电功等 |
|
表 1 自发过程举例
Table 1 Examples of spontaneous process
|
【问】高温高压下,N2 ( g)+ 3H2 ( g)→2NH3 ( g)为自发反应。说明反应物N2 ( g)和H2 ( g)的吉布斯自由能之和( G 1) 大于产物NH3(g)的吉布斯自由能( G 2) ,反应过程是自由能减小的过程,如果反应物N2 ( g)、H2 ( g)全部生成产物NH3 ( g)的话,岂不是自由能更小,为何是反应物部分转化,而达到化学平衡状态为止?
【答】本问是关于自发化学反应的方向和限度的问题,深入讨论超出中学教学范围。简单地说,反应物N2 ( g)、H2 ( g)的自由能之和( G 1) 大于产物NH3 ( g)的自由能( G 2) ,则反应物可以自发地生成产物,这是反应自发进行的方向。然而在反应过程中,反应物和产物的自由能不是固定不变的。参加反应的物质N2 ( g)、H2 ( g)、NH3 ( g)3者处于混合态,产生了混合自由能。其混合自由能低于各自纯态时的自由能。达到化学平衡状态时,反应体系的自由能最低(Δ G=0) ,这便是反应的限度。
3 过程自发性的判据
【问】为什么Δ G<0的过程是自发?Δ G>0的过程是非自发?
【答】根据热力学第一、二定律的数学表示式可以导出,在恒温恒压下,有
|
$\Delta G\le {{W}^{'}}$
|
(1)
|
式(1) 中 W '为过程的非体积功;“=”表示过程可逆(R);“<”表示过程不可逆(IR)。那么表达过程可逆性的公式(1) 如何与过程的自发性联系起来呢?讨论如下:
(1) 若Δ G>0,则 W ' >0,表示过程进行时(无论可逆或不可逆),都是环境对体系做功,则该过程一定为非自发过程。
(2) 若Δ G<0,则 W R'<0,表示过程可逆进行时,体系还可能对环境做功(体系具有做功能力),则该过程为自发过程。
由此可见,在等温等压下根据Δ G 的正负即可判断过程的自发性。另外,上面讨论的自由能判据与自发过程的定义统一起来。不难理解,在自发过程的定义中的“外力”为什么是指“功”,以及Δ G>0或Δ G<0意味着什么(即自发性判据的适用性)。
【问】“利用焓判据(Δ H<0) 或熵判据(Δ S >0) 判别自发过程都是片面的,而由焓判据和熵判据组成的自由能判据,则适用于所有的过程。”这种说法是否准确?
【答】这种说法是基于Δ G=Δ H - T Δ S 公式对自由能判据的解读,为了准确把握,需要从更深刻的知识背景去思考和审视。从热力学函数判据的演绎过程可知[6],熵 (S )、热力学能 (U )、焓 (H )、亥姆霍兹自由能 (A )以及吉布斯自由能( G )的各判据分别是:Δ S >0(隔离体系);(Δ U ) S ,V <0;(Δ H ) S ,p <0;(Δ A ) T ,V <0;(Δ G ) T,p <0。除熵判据需要在隔离体系之外,其余各判据都是选定2个独立的状态变量作为适用条件,这2个状态变量分别由一个热学变量( T ,S )和一个力学变量( p ,V )构成,并称之为“特性变量”。由此需要明确以下2点:
(1) 提及热力学函数的自发性判据,需要指出在什么条件下。不存在没有限制条件的“万能判据”。 U 、 H 、 A 和 G 各判据,只有在其“特性变量”对应的条件下判别才是准确的,否则是片面的。
(2) 就各判据的数学形式而言,U 、 H 、 A 和 G 的地位是等同的,都可以独立作为自发性判据,只不过由于吉布斯自由能判据所适用的条件(等温等压)最为常见,应用最多而已。
因此,本问的说法,按学科语言应理解为:在等温等压条件下,用焓判据(Δ H<0) 或熵判据(Δ S >0) 判别过程的自发性都是片面的,而适合用吉布斯自由能判据。
【问】金属钠与硫酸铜溶液反应时不是置换出铜,而是和水反应生成了氢氧化钠和氢气,但从理论上讲,铜离子的氧化性更强,应该是铜离子得电子。可否查阅钠与水反应、钠与铜离子反应的吉布斯自由能数据,进行比较予以说明?
【答】通过比较化学反应Δ G 负值的大小,判别反应实际进行的方向(即Δ G 越负,最有可能发生),将热力学问题与动力学问题混为一谈,这是中学教师最容易犯的错误。
前已指出,热力学理论所预言的自发过程仅代表变化方向的一种可能性。反应的Δ G 越负,只表明该反应的热力学倾向越大,并非最有可能发生。在判别竞争反应的方向时,应首先区分反应进行时属于下列哪种情况:(1) 平衡控制;(2) 速率控制。如果反应受平衡控制,则Δr Gmθ越负的反应,生成产物的比例越大;如果反应受速率控制,则反应速率大的反应,生成产物比例越大。例如,金属钠与硫酸铜溶液反应时,反应并未处于平衡状态,不能用热力学判别。即使查到Δ G 的数据进行比较,往往也会得出错误的结论。而应该用速率判别,即比较2者反应速率的大小。通俗地讲,将金属钠投入水溶液中后,周围都是水分子,相比铜离子处于水合状态,所以首先与水反应,即钠与水反应的速率更快。
4 引入自发过程概念的意义
【问】既然自发性判据在实际运用时会受到诸多限制,那么将化学反应区分为自发和非自发的意义何在?
【答】区分为自发和非自发的意义在于,对反应的方向和限度做出预判。即在指定条件下,什么过程可能进行,限度是多少,什么过程不可能进行,这些问题的解决,使我们在设计化学反应路线时,能够事先在理论上做出判断,从而避免因盲目实验所造成的浪费。
例如,在298 K、 pθ下,苯和NH3直接生成苯胺和H2的反应:
C6H6 ( l)+NH3 ( g)= C6H5NH2 ( l)+H2 ( g)
计算得知,该反应的Δr Gmθ= 41.2 kJ·mol-1,标准平衡常数 Kθ= 6.08×10-8,即反应不能自发进行(高温高压也难进行),使用催化剂无济于事。但热力学理论不排除在输入电能或光能的情况下可以进行,研究表明,在CO2红外激光( ν= 943 cm-1)照射下,常温常压下可以实现合成苯胺。
又如,汽车尾气处理反应:
2CO ( g)+ 2NO ( g)=2CO2 ( g)+ N2 ( g)
Δr Gmθ(298.2 K)= -343.74 kJ·mol-1,K = 1.68×1060。
从热力学角度看,这是一个自发倾向很大的反应,即使在汽车尾气的低浓度条件下,反应也是很完全的。但由于动力学原因,实际转化率很低,从而迫使人们去寻找高效催化剂。
【问】借助于外力可以使非自发反应进行,有哪些方法?
【答】使非自发反应进行通常有以下3种途径:
(1) 改变反应的始、终状态。即改变反应的温度或压力,使原来Δ G>0的反应转化为Δ G<0。例如:在常温下CaCO3 ( s)分解成CaO ( s)和CO2 ( g)为非自发,但在高温下为自发;又如,石墨转化成金刚石在常压下为非自发,在高压下为自发等。
(2) 做非体积功,即输入电能或光能。所输入的非体积功 W ' 满足: W ' >Δ G ,即可使反应逆转。例如,电解水制氢气;利用光能进行光合作用等。
(3) 利用反应的“耦合”。反应“耦合”的本质是用一个自发的化学反应启动一个非自发的化学反应。例如,在800 ℃、 pθ下:
|
$F{{e}_{2}}{{O}_{3}}~\left( s \right)=\text{ }2Fe\left( s \right)+\frac{3}{2}{{O}_{2}}\left( \text{ }g \right)$
|
(2)
|
|
$3CO\left( g \right)+\frac{3}{2}{{O}_{2}}\left( g \right)=3C{{O}_{2}}\left( \text{ }g \right)~$
|
(3)
|
|
$F{{e}_{2}}{{O}_{3}}\left( s \right)+3CO\left( g \right)=2Fe\left( \text{ }s \right)+3C{{O}_{2}}\left( \text{ }g \right)$
|
(4)
|
便可自发进行。
中学化学教科书是以学生为主要读者,在处理教材的相关概念和理论时,应尽可能具体化、简约化、通俗易懂。例如,“不借助外力就可以自动进行的过程……”“实现后者(非自发)的先决条件是要向体系输入能量”,用“外力”“能量”代替专业概念“功”,以增加可读性;又如,“利用焓判据(Δ H<0) 或熵判据(Δ S >0) 判别自发过程都是片面的,而由焓判据和熵判据组成的自由能判据,则适用于所有的过程”,是为了避开严格的数学推导有关定律和原理。正是对教材的这些内容进行补充和深化,帮助教师在学科层面上理解化学反应原理,而不是仅仅停留在教材层面上。
 2016, Vol. 37
2016, Vol. 37  Issue(15): 67-70
Issue(15): 67-70  2016, Vol. 37
2016, Vol. 37  Issue(15): 67-70
Issue(15): 67-70