Ferrous Ion and Ferrous Hydroxide Which is More Easily Oxidized in the Air
Linyi No.4 High School, Linyi 276037, China
1 问题的提出
由于Fe2+和Fe3+离子结构的稳定性不同,Fe2+容易被氧化成Fe3+,例如亚铁盐溶液被空气中的氧气氧化,离子方程式为:
|
$12F{{e}^{2+}}+3{{O}_{2}}+6{{H}_{2}}O=8F{{e}^{3+}}+4Fe{{\left( OH \right)}_{3}}~\left( 无外加酸条件 \right)$
|
(1)
|
或
|
$4F{{e}^{2+}}+{{O}_{2}}+4{{H}^{+}}=4F{{e}^{3+}}+2{{H}_{2}}O\left( 酸性较强环境 \right)$
|
(2)
|
Fe(OH)2虽然难溶,也能被空气中的氧气氧化:
|
$4Fe{{\left( OH \right)}_{2}}+{{O}_{2}}+2{{H}_{2}}O=4Fe{{\left( OH \right)}_{3}}$
|
(3)
|
比较以上3个反应,如果单从反应物Fe2+和Fe(OH)2来看,因为Fe(OH)2是难溶物质,似乎反应(1) (2) 比(3) 容易发生,但结合生成物来看,反应(1) (3) 中均有更难溶的Fe(OH)3[1]生成,反应(2) 中较大的c(H+)会促进水的生成,这就使情况变得有些复杂。究竟Fe2+和Fe(OH)2谁更易被空气氧化?
2.1 反应4Fe(OH)2+O2+2H2O=4Fe(OH)3
上述反应由以下2个电对构成:
空气中O2分压按(1/5) ×101.325 kPa计算,代入能斯特方程:
解得E=0.9507 V
在p(O2)不变的情况下,该反应的E是定值。
2.2 反应4Fe2++O2+4H+=4Fe3++2H2O
上述反应是在溶液酸性较强时Fe2+的氧化反应。由以下2个电对构成:
该反应构成的原电池电动势受c(Fe2+)、c(Fe3+)等变化的影响,现以0.1000 mol/L含Fe2+的盐溶液的氧化为例计算反应在进行不同程度时的电动势。
已知0.1000 mol/L Fe2+溶液因水解pH=6.8406,0.1000 mol/L Fe3+溶液水解的pH>1.8674[3]。设溶液的pH=0并保持不变,这种情况下无需考虑水解问题。
假若Fe2+有0.0010%被氧化,则c(Fe2+)≈0.1000 mol/L,c(Fe3+)=1.0000×10-6 mol/L,此时反应4Fe2++O2+4H+=4Fe3++2H2O的电动势为:
将相关数据代入可解得E=0.7437 V
同理可以计算出Fe2+在不同氧化程度时反应的电动势,列于表 1。
表 1
Table 1
表 1(Table 1)
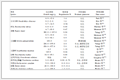
表 1 0.1000 mol/L Fe2+溶液在pH=0时反应4Fe2++O2+4H+=4Fe3++2H2O的电动势随Fe2+氧化程度的变化
Table 1 Change of electromotive force in the reaction 4Fe2++O2+4H+=4Fe3++2H2O with the degree of oxidation of ferrous ion (c(Fe2+)=0.1000 mol/L, pH=0)
| Fe2+氧化程度/% | 3.1815×10-7 | 0.0010 | 0.0500 | 0.1000 | 1.0000 | 10.00 | 50.00 | 80.00 | 99.00 |
| E/V | 0.9507 | 0.7437 | 0.6431 | 0.6252 | 0.5658 | 0.5041 | 0.4477 | 0.4120 | 0.3295 |
|
表 1 0.1000 mol/L Fe2+溶液在pH=0时反应4Fe2++O2+4H+=4Fe3++2H2O的电动势随Fe2+氧化程度的变化
Table 1 Change of electromotive force in the reaction 4Fe2++O2+4H+=4Fe3++2H2O with the degree of oxidation of ferrous ion (c(Fe2+)=0.1000 mol/L, pH=0)
|
2.3 反应12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3
在无外加酸条件下,上述反应由以下2个电对构成:
该负极反应的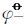 数据不易查到,可用下列方法求算[4]:
数据不易查到,可用下列方法求算[4]:
先设计如下可逆电池:
正极反应:3Fe3++3e-3Fe2+
负极反应:$3F{{e}^{2+}}+3O{{H}^{}}-3{{e}^{}}\rightleftharpoons 2F{{e}^{3+}}+Fe{{\left( OH \right)}_{3}}$ 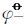
电池反应:$F{{e}^{3+}}+3O{{H}^{-}}\rightleftharpoons Fe{{\left( OH \right)}_{3}}\begin{array}{*{35}{l}}
{} \\
K=1/c\left( F{{e}^{3+}} \right){{c}^{3}} \\
1/{{K}_{sp}}\left[ Fe{{\left( OH \right)}_{3}} \right] \\
\end{array}\left( O{{H}^{-}} \right)=$
由热力学可知,上述反应达平衡时有
(已知Ksp[Fe(OH)3]=4×10-38 [1-2])
按标准电动势的计算方法,由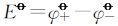
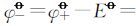
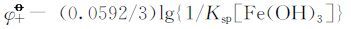
将相关数据代入可求得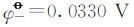
2.3.1 反应12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3标准电动势和标准平衡常数的计算
由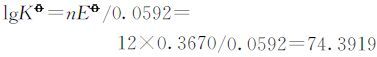
解得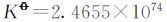
2.3.2 反应12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3不同氧化程度时电动势的计算
仍以0.1000 mol/L的Fe2+ 盐溶液的氧化来讨论。
假若Fe2+有0.0010%被氧化,则c(Fe2+)=0.1000 mol/L-1.0000×10-6 mol/L,生成的Fe3+总浓度为2/3×10-6 mol/L,通过计算可以求得这些Fe3+有[(2/3) ×10-6-(16/5) ×10-13] mol/L发生水解,溶液中的c(Fe3+)只有(16/5) ×10-13 mol/L。
将已知的c(Fe2+)、c(Fe3+)和p(O2)各数据代入
可求得该氧化程度下的E=0.7413 V
同理,可分别求出Fe2+不同氧化程度时的c(Fe2+)、c(Fe3+)和电动势,列于表 2。
表 2
Table 2
表 2(Table 2)

表 2 0.1000 mol/L的Fe2+盐溶液发生12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3反应的浓度变化与E关系
Table 2 Relationship between ion concentration and electromotive force of the reaction 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3 (initial concentration: c(Fe2+)=0.1000 mol/L)
| Fe2+氧化程度/% | 4.2×10-14 | 0.0010 | 0.0100 | 0.1000 | 1.0000 | 10.00 | 99.00 |
| c(Fe2+)/(mol/L) | 0.1000-4.2099×10-17 | 0.1000-1.0000×10-6 | 0.1000-1.0000×10-5 |
0.0999 | 0.0990 | 0.0900 | 0.001 |
| c(Fe3+)/(mol/L) | 2.8066×10-17 | 3.2000×10-13 | 3.2000×10-10 | 3.2000×10-7 | 1.4944×10-4 | 5.0000×10-3 | 6.214×10-2 |
| E/V | 0.9507 | 0.7413 | 0.6722 | 0.5529 | 0.4482 | 0.3856 | 0.2267 |
|
表 2 0.1000 mol/L的Fe2+盐溶液发生12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3反应的浓度变化与E关系
Table 2 Relationship between ion concentration and electromotive force of the reaction 12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3 (initial concentration: c(Fe2+)=0.1000 mol/L)
|
3 对Fe(OH)2和Fe2+被空气氧化反应难易的分析
3.1 关于二价铁的氧化速率
根据动力学研究,二价铁的氧化速率情况是[5]:
pH<5.5时,υ=1×10-25 atm-1·min-1·c(Fe2+)·p(O2)
pH>5.5时,υ=8×1013 L2·atm-1·min-1·mol-2·c(Fe2+)·c2(OH-)·p(O2)
由此可知,外加酸和不加酸条件下Fe2+的氧化速率是很慢的,而Fe(OH)2的氧化速率极快。
3.2 对标准平衡常数的讨论
将以上计算的3个反应的标准平衡常数进行比较:
4Fe2++O2+4H+=4Fe3+ +2H2O(有外加酸) 
3个反应的平衡常数都很大,说明都能反应得比较完全[6-7]。3者差值较大,最大的是无外加酸条件下Fe2+的氧化,最小的是有外加酸时Fe2+的氧化。这说明在无外来酸时,自由的Fe2+相比Fe(OH)2能被氧化得更彻底。由于实验中用的Fe2+盐溶液在配制时都人为地加入了酸,酸的存在阻止了溶解度极小的Fe(OH)3的生成,所以这时的Fe2+不如Fe(OH)2氧化得彻底。
3.3 对3个构成负极电对的电极电位的讨论
比较3个反应中构成负极电对的电极电位:
可知在标准状态时的还原性顺序[7-8]为:Fe(OH)2>非酸性条件下的Fe2+>酸性条件下的Fe2+。由于它们是被同一种氧化剂氧化,所以在标准状态时氧化的难易也是这样的顺序。
3.4 对反应电动势的讨论
(1) Fe(OH)2氧化的E=0.9507 V,较大且不随反应过程变化。(2) 2种条件下Fe2+氧化的E都随Fe2+的不断氧化逐渐变小。开始氧化时的E都会比Fe(OH)2氧化的E大,但仅在刚开始的短暂阶段(如pH=1时Fe2+的氧化小于(3.1815×10-7)%时),其后E都比Fe(OH)2氧化的E小,并且差距较快拉大。(3) Fe2+氧化程度相同时,加酸比不加酸条件下Fe2+氧化的E要大。由此可知,Fe(OH)2在整个氧化过程中一直保持较大的反应趋势,Fe2+的氧化趋势随反应的进行逐渐减弱,且氧化程度相同时,有外加酸比无外加酸条件下的反应趋势要大。由于电极电势是热力学数据,用于判断反应的方向和程度,与化学反应速率无关[7], 所以反应趋势大不代表氧化的快。
3.5 小结
所谓Fe2+和Fe(OH)2氧化的难易实际上应包括2个方面:(1) 反应进行的程度,(2) 反应进行的速率。由以上讨论,得到如下结论:
反应进行的趋势是(Fe2+同等氧化程度):Fe(OH)2>酸性条件下的Fe2+>Fe2+;
标准状态时的还原性:Fe(OH)2>Fe2+>酸性条件下的Fe2+;
平衡时的氧化程度:Fe2+>Fe(OH)2>酸性条件下的Fe2+;
通常情况下反应的速率:Fe(OH)2>Fe2+>酸性条件下的Fe2+。
由于它们几乎都能完全氧化,所以从实际意义上讲,氧化的难易应是反应速率的体现。
 2016, Vol. 37
2016, Vol. 37  Issue(7): 69-71
Issue(7): 69-71  2016, Vol. 37
2016, Vol. 37  Issue(7): 69-71
Issue(7): 69-71